
| ĪĀ¶Č/”ę | 0 | 10 | 20 | 30 | 40 |
| KNO3£ØČܽā¶Č/g£© | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 |
| A£® | KNO3±„ŗĶČÜŅŗÖŠ²»ÄÜŌŁČܽāČĪŗĪĪļÖŹ | |
| B£® | 40”ꏱ100gµÄKNO3±„ŗĶČÜŅŗŗ¬KNO3µÄÖŹĮæĪŖ63.9g | |
| C£® | 30”ꏱ£¬KNO3ČÜŅŗµÄČÜÖŹÖŹĮæ·ÖŹżĪŖ45.8% | |
| D£® | 20”ꏱµÄKNO3±„ŗĶČÜŅŗ½µĪĀÖĮ0”ę£¬ÓŠ¾§ĢåĪö³ö |
·ÖĪö ĄūÓĆČܽā¶ČµÄøÅÄī¼°ŅāŅ壬¶Ō±ķÖŠµÄŹż¾Ż½ųŠŠ·ÖĪö£®øł¾ŻĻõĖį¼ŲŌŚ²»Ķ¬ĪĀ¶ČĻĀµÄČܽā¶ČæÉÖŖ£¬ĻõĖį¼ŲµÄČܽā¶ČĖęĪĀ¶ČÉżø߶ųŌö“ó£¬ĄūÓĆÕāŠ©ŠÅĻ¢½įŗĻĖłŃ§µÄÓŠ¹ŲÖŖŹ¶½ā¾ö“ĖĢā£®
½ā“š ½ā£ŗA”¢±„ŗĶČÜŅŗŹĒ¶ŌijÖÖ¾ßĢåµÄČÜÖŹ¶ųŃŌµÄ£¬±„ŗĶČÜŅŗÖŠ»¹ÄÜČܽāĘäĖūČÜÖŹ£¬¹ŹA“ķĪó£»
B”¢40”ꏱ£¬ĻõĖį¼ŲµÄČܽā¶ČŹĒ63.9g£¬ĖłŅŌ163.9gµÄKNO3±„ŗĶČÜŅŗŗ¬KNO3µÄÖŹĮæĪŖ63.9g£¬¹ŹB“ķĪó£»
C”¢30”ꏱ£¬ĻõĖį¼Ų±„ŗĶČÜŅŗµÄČÜÖŹÖŹĮæ·ÖŹżĪŖ$\frac{45.8g}{145.8g}$”Į100%=31.4%£¬¹ŹC“ķĪó£»
D”¢ĻõĖį¼ŲµÄČܽā¶ČĖęĪĀ¶ČµÄ½µµĶ¶ų¼õŠ”£¬ĖłŅŌ20”ꏱµÄKNO3±„ŗĶČÜŅŗ½µĪĀÖĮ0”ę£¬ÓŠ¾§ĢåĪö³ö£¬¹ŹDÕżČ·£®
¹ŹŃ”£ŗD£®
µćĘĄ “ĖĢāŹĒ¶ŌČܽā¶Č¼°Ó°ĻģŅņĖŲµÄ漲飬½āĢāµÄ¹Ų¼üŹĒ¶ŌČܽā¶Čŗ¬ŅåµÄĄķ½ā¼°¶ŌÓ°ĻģČܽā¶Č“óŠ”ŅņĖŲµÄÕĘĪÕ£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
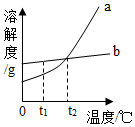 Į½ÖÖ²»ŗ¬½į¾§Ė®µÄ¹ĢĢåĪļÖŹa”¢bµÄČܽā¶ČĒśĻßČēĶ¼£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
Į½ÖÖ²»ŗ¬½į¾§Ė®µÄ¹ĢĢåĪļÖŹa”¢bµÄČܽā¶ČĒśĻßČēĶ¼£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| A£® | bµÄČܽā¶ČŠ”ÓŚaµÄČܽā¶Č | |
| B£® | aµÄ²»±„ŗĶČÜŅŗÓÉt2”ę½µĪĀÖĮt1”ꏱ±ä³É±„ŗĶČÜŅŗ | |
| C£® | ·Ö±š½«t2”ꏱa”¢bĮ½ÖÖĪļÖŹµČÖŹĮæµÄČÜŅŗ½µĪĀÖĮt1”ę£¬Īö³ö¾§ĢåµÄÖŹĮæa“óÓŚb | |
| D£® | ÅصÄbČÜŅŗÖŠŗ¬ÓŠÉŁĮæa£¬Ķس£æɲÉÓĆÕō·¢ČܼĮµÄ·½·ØµĆµ½b¾§Ģå |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
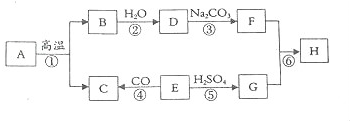
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
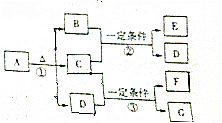 A-G7ÖÖĪļÖŹÖ®¼äµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£¬ĒŅB”¢C”¢GŌŚ³£ĪĀĻĀŹĒĘųĢ壬DŹĒŅŗĢ壬E”¢FŹĒÓŠ»śĪļ£¬FµÄĻą¶Ō·Ö×ÓÖŹĮæŹĒEµÄ3±¶£®AµÄĻą¶Ō·Ö×ÓÖŹĮæŹĒ79£®EÖŠµÄ4ÖÖŌŖĖŲµÄŌ×ÓøöŹż±ČĪŖ1£ŗ1£ŗ2£ŗ4
A-G7ÖÖĪļÖŹÖ®¼äµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£¬ĒŅB”¢C”¢GŌŚ³£ĪĀĻĀŹĒĘųĢ壬DŹĒŅŗĢ壬E”¢FŹĒÓŠ»śĪļ£¬FµÄĻą¶Ō·Ö×ÓÖŹĮæŹĒEµÄ3±¶£®AµÄĻą¶Ō·Ö×ÓÖŹĮæŹĒ79£®EÖŠµÄ4ÖÖŌŖĖŲµÄŌ×ÓøöŹż±ČĪŖ1£ŗ1£ŗ2£ŗ4²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ½ųČėĆŗæóŹ±²»ÓĆ»š°ŃÕÕĆ÷£¬æÉÓĆæó¾®×ØÓĆŹÖµēĶ²ÕÕĆ÷ | |
| B£® | ÉÕ¼ī²»É÷Õ³ŌŚĘ¤·ōÉĻ£¬Į¢¼“ÓĆ“óĮæĖ®³åĻ“ŗóĶæÉĻÅšĖįČÜŅŗ | |
| C£® | ÅØĮņĖį²»É÷½¦µ½Ę¤·ōÉĻ£®Į¢¼“ÓĆ“óĮæĖ®³åĻ“ŗóĶæÉĻŠ”ĖÕ“ņČÜŅŗ | |
| D£® | ·¢ĻÖ·æ¼äÄŚµÄĢģČ»ĘųŠ¹Ā©Ź±£®Į¢¼““ņæŖÅÅ·ēÉČĶØ·ē»»Ęų |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | a+b-c | B£® | a+b+c | C£® | $\frac{177}{44}$£Øa+b-c£© | D£® | $\frac{44}{177}$£Øa+b-c£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
| ¼× | ŅŅ | ±ū | |
| m A/g | 2 | 4 | 6 |
| m B/g | 7 | 5 | 3 |
| m C/g | 3 | 6 | 9 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢ½¾æĢā
 ČēĶ¼ŹĒŹµŃéŹŅÖĘČ”¶žŃõ»ÆĢ¼µÄŅ»ÖÖ×°ÖĆ£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
ČēĶ¼ŹĒŹµŃéŹŅÖĘČ”¶žŃõ»ÆĢ¼µÄŅ»ÖÖ×°ÖĆ£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢ½¾æĢā
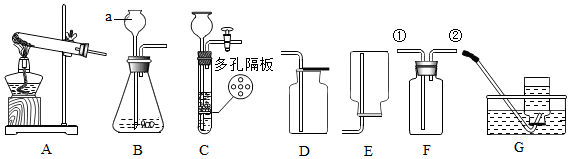
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com