
| A. | 氮气的化学性质不活泼,常用作保护气 | |
| B. | 氧气化学性质比较活泼,属于可燃物 | |
| C. | 二氧化碳在空气中含量增多会使温室效应加剧,因此属于空气污染物 | |
| D. | 稀有气体在通电时发出不同颜色的光,发生了化学变化 |
分析 空气中各成分的体积分数分别是:氮气大约占78%、氧气大约占21%、稀有气体大约占0.94%、二氧化碳大约占0.03%、水蒸气和其它气体和杂质大约占0.03%;氮气的化学性质不活泼,氮气的用途是:制造氮肥、氮气充入食品包装袋内可以防腐即做保护气、液态氮可以做制冷剂;氧气化学性质比较活泼,有助燃性,没有可燃性,不属于可燃物;二氧化碳在空气中含量增多会使温室效应加剧,但是二氧化碳是空气的成分,不属于空气污染物;稀有气体在通电时发出不同颜色的光,没有发生化学变化.
解答 解:A、氮气的化学性质不活泼,氮气的用途是:制造氮肥、氮气充入食品包装袋内可以防腐即做保护气、液态氮可以做制冷剂;故选项正确;
B、氧气化学性质比较活泼,有助燃性,没有可燃性,不属于可燃物;故选项错误;
C、二氧化碳在空气中含量增多会使温室效应加剧,但是二氧化碳是空气的成分,不属于空气污染物,故选项错误;
D、稀有气体在通电时发出不同颜色的光,没有发生化学变化,故选项错误;
故选A
点评 本考点考查了空气中各种气体的含量和用途等,同学们要加强记忆有关的知识点,在理解的基础上加以应用,本考点基础性比较强,主要出现在选择题和填空题中.


科目:初中化学 来源: 题型:选择题
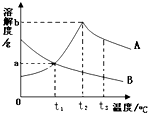
| A. | A物质的溶解度随温度升高而增大 | |
| B. | 将t1℃时A、B两物质的饱和溶液升温到t2℃,仍然都是饱和溶液 | |
| C. | 将t2℃时A、B两物质的饱和溶液升温到t3℃,仍然都是饱和溶液 | |
| D. | t1℃时,A、B两物质的饱和溶液溶质的质量分数都是a% |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
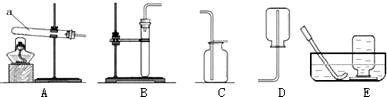
| 制取气体 | 反应的化学方程式 | 反应物状态 | 反应条件 | 发生装置 | 气体的物理性质 | 收集装置 |
| O2 | ①2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | 固体 | 加热 | A | 不易溶于水密度比空气略大 | ②E(或C) |
| CO2 | CaCO3+2HCl═CaCl2+H2O+CO2↑ | 固体液体 | 常温 | ③B | 可溶于水密度比空气大 | C |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 如图为某学生进行粗盐提纯实验中过滤操作的示意图,试回答:
如图为某学生进行粗盐提纯实验中过滤操作的示意图,试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com