
 金属是一种非常重要的资源,在生产、生活中有着广泛的用途.
金属是一种非常重要的资源,在生产、生活中有着广泛的用途.分析 (1)明确炼铁的原料;
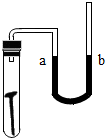
(2)铁生锈是和水、氧气反应所致,消耗氧气,液面上升;
(3)防止铁生锈的一般措施,隔绝空气和水;
(4)给定四种金属和氢的活动关系由高到低的顺序为为Al Fe H Cu Ag,结合固体滴加盐酸有气泡,说明铁有剩余,进一步分析判断;
(5)根据信息写出对应的化学方程式,然后计算.
解答 解:(1)人类向自然界提取量最大的金属是铁,高炉炼铁的原料是铁矿石,空气,石灰石和和焦炭;
(2)在盛水的试管中放一根洁净的铁钉,环境潮湿,有水,也有空气,U形管内水面处于同一高度,数天后,慢慢生锈,生锈是消耗水和氧气的,导致a侧液面 上升,产生此现象的原因是 铁钉在潮湿的环境下和水氧气反应生锈,从而消耗了氧气,导致a侧液面上升.
(3)请你提出一条防止钢铁锈蚀的合理措施 刷漆、抹油,做镀层或者加工为不锈钢(具体措施要结合物质的使用用途和环境以及价值来选择).
(4)给定四种金属和氢的活动关系由高到低的顺序为为Al Fe H Cu Ag.在Cu(NO3)2、Al(NO3)3、和AgNO3的混合溶液中加入一定量的铁粉,充分反应(铁最先和硝酸银反应,然后和硝酸铜反应,不和硝酸铝反应)后过滤,向滤出的固体(一定有银和铜,可能有铁,一定无铝)上滴加稀盐酸时有气泡产生(说明固体有铁,也就是铁完全消耗掉硝酸银和硝酸铜后依然有剩余,),则反应所得溶液中含有的金属离子有铝粒子和亚铁粒子,无铜离子和银离子.混合物和铁反应分别为,且质量关系如下
Cu(NO3)2+Fe=Fe(NO3)2+Cu 固体变化
56 64 56-64=-8,则溶解质量减小
或者2AgNO3+Fe=2Ag+Fe(NO3)2固体变化
56 216 56-218=-162,则溶解质量减小
反应后溶液的质量比原混合溶液质量 小.
有关反应的化学方程式为 Cu(NO3)2+Fe=Fe(NO3)2+Cu或者2AgNO3+Fe=2Ag+Fe(NO3)2
或者Fe+2HCl=FeCl2+H2↑(写一个即可).
(5)工业上可利用“铝热反应”焊接钢轨,冶炼难溶金属等,其原理是在高温下用铝将某些金属从其氧化物中置换出来,若用铝与四氧化三铁反应来制取25.2kg铁,则对应的化学方程式为8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe(配平时用最小公倍数法,从氧元素入手.或者说观察法).
设理论上需要消耗铝的质量是x
8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe
8×27 9×56
x 25.2kg
$\frac{8×27}{9×56}$=$\frac{x}{25.2kg}$
x=10.8kg
故答案为:
(1)焦炭;(2)上升;铁钉在潮湿的环境下和水氧气反应生锈,从而消耗了氧气,导致a侧液面上升.
(3)刷漆(合理即可).
(4)Al 3+、Fe 2+;小; Cu(NO3)2+Fe=Fe(NO3)2+Cu或者2AgNO3+Fe=2Ag+Fe(NO3)2或者Fe+2HCl=FeCl2+H2↑(写一个即可).
(5)10.8kg
点评 本题涉及内容较多,不要被一下吓晕,要逐一慢慢梳理解答,尽心思考,难度不大.


 习题精选系列答案
习题精选系列答案科目:初中化学 来源: 题型:解答题
 已知A、B、C、D、E、F六种物质间有如图所示的转变关系(发生的反应都是化合反应),其中A、B、C在通常情况下是三种无色无味的气体,且C为化合物,D是一种无色的液体氧化物,F是一种能使紫色石蕊试液变红的物质.
已知A、B、C、D、E、F六种物质间有如图所示的转变关系(发生的反应都是化合反应),其中A、B、C在通常情况下是三种无色无味的气体,且C为化合物,D是一种无色的液体氧化物,F是一种能使紫色石蕊试液变红的物质.查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 将水进行过滤,使硬水转化为软水 | |
| B. | 在城乡大力开展植树造林,防止水土流失 | |
| C. | 用消毒剂ClO2进行消毒,减少水中有害物质 | |
| D. | 减少化肥、农药的使用,发展生态农业 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A、化学与人体健康 | B、资源的利用和保护 |
| ①人体缺锌会导致甲状腺肿大 ②吸入一氧化碳会使人体中毒 | ①涂油漆、涂防锈油可防止金属锈蚀 ②石油是不可再生资源,只作燃料使用 |
| C、节能环保的措施 | D、垃圾的分类回收 |
| ①电器不使用时,及时拔掉插头 ②绿色植物既可保护水土又可制造氧气 | ①厨余垃圾、树叶等是有害垃圾 ②饮料瓶、易拉罐等是可回收垃圾 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 甲酸由1个碳原子、2个氢原子、2个氧原子构成 | |
| B. | 甲酸属于氧化物 | |
| C. | 甲酸中氧元素的质量分数最大 | |
| D. | 甲酸中碳、氢、氧元素质量比为1:2:2 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 某兴趣小组根据实验室提供的仪器和药品进行了氧气的制备实验.
某兴趣小组根据实验室提供的仪器和药品进行了氧气的制备实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com