
 某同学对实验室制取CO2的实验进行探究.
某同学对实验室制取CO2的实验进行探究.分析 (1)浓盐酸具有挥发性,会使制取的二氧化碳不纯
(2)实验结束后,为确定反应后溶液的成分,某同学提出可滴加酚酞进行确定.由于酚酞只有遇到碱才变成红色,中性和酸性都不变色,而给定溶液可能酸性也可能是中性,所以不能检测.
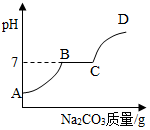
(3)根据图可知,起始阶段没有沉淀产生,说明此时溶液为酸性,随着碳酸钠的不断加入,酸被完全反应,继续加入碳酸钠,则生成碳酸钙沉淀,C点时恰好完全反应,此时溶质只有氯化钠,所以加入硝酸银生成氯化银沉淀和硝酸钠.
(4)某同学将CO2通入NaOH溶液中,无明显现象,请设计实验证明两者发生了反应,是证明生成的产物为碳酸钠,而不适合用检测溶液酸碱性或者pH
(5)根据质量守恒定律可知,过程中质量的减少是因为生成了二氧化碳,所以可以求算二氧化碳的质量,根据二氧化碳和对应的化学方程式求算碳酸钙和HCl的质量,进而求算对应的质量分数.
解答 解:
(1)实验室制取CO2不用浓盐酸的原因是 浓盐酸具有挥发性,会使制取的二氧化碳不纯?
(2)实验结束后,为确定反应后溶液的成分,由于此时可能是恰好完全反应,也可能是盐酸过量,而酚酞遇到酸性或者中性溶液时都不能变色,所以不能用酚酞确定溶液的成分.
(3)另取少量反应后溶液,向其中逐滴加入Na2CO3溶液,溶液pH变化如图所示.开始是酸性,所以溶液应该是盐酸和氯化钙的混合物,所以开始阶段有气泡生成,BC段是盐酸反应完全,而氯化钙和碳酸钠反应生成碳酸钙沉淀,所以对应的现象是产生白色沉淀.C点是盐酸和氯化钙都已经完全转化为氯化钠,所以加入硝酸银时氯化钠和硝酸银反应生成氯化银沉淀和硝酸钠.
(4)某同学将CO2通入NaOH溶液中,由于反应生成碳酸钠,所以设计实验证明两者发生了反应,实际上是证明碳酸钠的存在,也就是检验碳酸根,可以加入酸转化为气体,也可以加入可溶性钙盐、钡盐、氢氧化钙或者氢氧化钡等,合理即可.
(5)根据质量守恒定律可得,二氧化碳的质量=12.5g+50g-58.1=4.4g
该石灰石样品中碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g
$\frac{100}{44}$=$\frac{x}{4.4g}$
x=10g
石灰石样品的纯度为$\frac{10g}{12.5g}$×100%=80%.
故答案为:
(1)浓盐酸具有挥发性,会使制取的二氧化碳不纯;
(2)不合理,反应后溶液可显酸性或者中性,都不能使酚酞变色.
(3)产生白色沉淀. NaCl+AgNO3=NaNO3+AgCl↓.
(4)取少量反应后的溶液,滴加足量稀盐酸,若产生气泡,说明发生了反应(合理即可).
(5)80%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.


科目:初中化学 来源: 题型:多选题
| A. | O2 | B. | H2O和CO2 | C. | O2和H2O | D. | CH3CH2OH |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 反应前后原子总数减少 | B. | 反应物和生成物中共有两种氧化物 | ||
| C. | 可用于减少温室气体的排放 | D. | 得到的液体燃料化学式是H2C2O |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | X的金属活动性比Cu强 | B. | X可能是金属Fe | ||
| C. | 滤液中一定含有Cu(NO3)2 | D. | 滤渣中一定含有Ag |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图为某反应的微观示意图,该反应中化合价发生改变的元素是氯元素,将反应后的溶液稀释,溶液的pH会变大(选填“变大”“变小”或“不变”),若将反应后溶液与NaOH恰好完全反应,所得溶液中溶质为NaCl和NaClO.
如图为某反应的微观示意图,该反应中化合价发生改变的元素是氯元素,将反应后的溶液稀释,溶液的pH会变大(选填“变大”“变小”或“不变”),若将反应后溶液与NaOH恰好完全反应,所得溶液中溶质为NaCl和NaClO.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用活性炭除冰箱中的异味 | B. | 用金刚石裁玻璃 | ||
| C. | 用汽油清洗衣物上的油污 | D. | 用洁厕灵清楚卫生器具上的顽渍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com