
����Ŀ�������г������ʵ����ʺ�ʵ���ǻ�ѧ�о�����Ҫ���ݣ�

��1������һƿ������ͼ��ʾ���Ȼ�����Һ��С��ͬѧ���Ƶ��Ȼ�����Һ��������ƫС�ˣ� ��д���������п��ܳ��ֵĴ���_____��______________________����ʾ��1g ���������룬������ �㣩������ 15%���Ȼ�����Һ������ 500g ������������Ϊ 0.9%���Ȼ�����Һ����Ҫ��ˮ ������Ϊ___________________��
��2��ͬѧ�ǰ���ͼ��ʾ��ʵ����ɺ����ν���Һ��������ͬһ�ྻ���ձ��У����㵹Һ ��ʱ���۲쵽��Һ�������ݲ�����
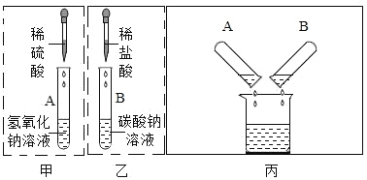
������ȷ����A �Թ��з�Һ���������_____________________________ ��д��ѧʽ����ͬ����B�Թ��з�Һ���������___________________________________��
��3��������ʽ�����Ƽ���ƵõĴ�����������Ȼ��ƣ�Ϊ�ⶨij������Ʒ��̼���Ƶ� ������ȡ 23g ��Ʒ�����ձ��У���ˮ�����ܽ⣬�ٵμ��Ȼ�����Һ������������������� ���Ȼ�����Һ��������ϵ��ͼ��ʾ����ô�����Ʒ��̼���Ƶ���������_______________________�����������һλС ���㣩
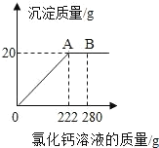
���𰸡������Ȼ���ʱ�������� ��ȡҺ��ʱ���ӿ̶� 470g H2SO4��Na2SO4 Na2CO3��NaCl 92.2%
��������
��1������һƿ������ͼ1��ʾ���Ȼ�����Һ��С��ͬѧ���Ƶ��Ȼ�����Һ��������ƫС�ˣ��������������˻����ܼ����ˣ������������п��ܳ��ֵĴ��� �����Ȼ���ʱ���������ȡҺ��ʱ���ӿ̶ȣ�����15%���Ȼ�����Һ������500g������������Ϊ0.9%���Ȼ�����Һ����Ҫ��ˮ������Ϊ500g��![]() ��470g��
��470g��
��2���������������Ʒ�Ӧ���������ƺ�ˮ��̼���������ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼��̼���������ᷴӦ���������ơ�ˮ�Ͷ�����̼�����㵹Һ��ʱ���۲쵽��Һ�������ݲ�����˵��̼���ƺ�������ʣ�࣬����A�Թ��з�Һ��������� H2SO4��Na2SO4��B�Թ��з�Һ��������� Na2CO3��NaCl��
��3���裺�ô�����Ʒ��̼���Ƶ���������Ϊx��

![]() x��92.2%��
x��92.2%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ݡ�ϵ�в�Ʒȥ������ǿ����ɫ����������Ҫ�ɷ��ǹ�̼���ƣ�2Na2CO33H2O2����ij��ѧ�С��Թ�̼���Ʋ�����Ũ�����Ȥ�������������̽����
���������ϣ�
��̼������ˮ��������Na2CO3��H2O2����ˮ��Һ����Na2CO3��H2O2��˫�����ʣ�
��̼���������ᷴӦ��2��2Na2CO33H2O2��+8HCl�T8NaCl+4CO2��+3O2��+10H2O��
��̼���Ƶ�ȥ��������Ҫ�����ڷ�Ӧ���ͷŴ��ġ����������йأ���������������Խ�ߣ�ȥ������Խǿ��
��1��20��ʱ���1%��̼����ˮ��Һ��pHΪ10.5��˵������Һ��_______��ѡ����ԡ��������ԡ������ԡ�����
��2�����̼����ˮ��Һ�м�������MnO2ʱ�����������ݣ�������Ӧ�Ļ�ѧ����ʽ��_______��
��3��Ϊ�ⶨij�������ݡ���Ʒ�С����������ĺ�����ȡ20g��Ʒ����ͼʵ��װ�����������ᷴӦ������֪��Ʒ�����ʲ�����ˮ�Ҳ������ᷴӦ��װ�����������ã���
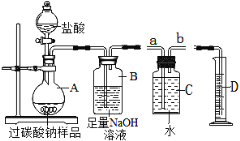
�ٽ����������ص���A�У���Ӧһ��ʱ��۲쵽________ʱ��ֹͣ�μ����ᡣ
��װ��B���������ɵ�CO2���÷�Ӧ�Ļ�ѧ����ʽ��_____________________________________��
��ijͬѧ����C��Dװ���ռ�����������O2��������� Bװ��������Cװ�õ�___�ˣ��a����b������
��ͼ��ʾ������Ӧ��A��������Һ����һϵ�в������õ�����NaCl������Ϊ11.7g����ݴ˼�����ù�̼������Ʒ�ġ���������������д���������̣���_______________
��ʾ����̼������Ʒ�С��������������ɰ����¹�ʽ���㣺
��������������=![]() ��100%
��100%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ����Һ�������������������ʮ����Ҫ�����á�
��1�������п�����_________����Ӳˮ����ˮ������ͨ��________�ķ�������ˮ��Ӳ�ȡ�
��2����ˮ�к��д������Ȼ��ƣ�����ͨ��_________������ô��Σ����ô˷����ᴿ�Ȼ��Ƶ�ԭ����____________ ��
��3����֪20��ʱ���Ȼ��Ƶ��ܽ��Ϊ36g������18g�Ȼ�������100g�Ȼ�����Һ��������Һ��Ũ��Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ճ������У����ǻ�Ӵ����ܶ�Ļ�ѧ���ʣ����ڵ�����̼�����ƣ��������ƣ������������ᣬ������̼��ѡ���ʵ������ʵĻ�ѧʽ����Ӧ�Ļ�ѧ������գ�
��1������θҺ�а�����������Ҫ����_____��
��2�������������ķ��ͷ۳ɷ�֮һ_____��
��3��д��¯����������Ҫ�ɷ��а����������ӷ���_____��
��4���������Ҫ�ɷ֣���������н���Ԫ�صĻ��ϼ�_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Ǽס����������ʵ��ܽ�����ߣ�����˵����ȷ���ǣ� ��

A.���ҹ����к��������ף��ɲ��ý��½ᾧ�ķ����ᴿ��
B.���ס����������ʵIJ�������Һ��Ϊ������Һ�����Բ�����ͬ�ķ���
C.�ֱ����ļס��ҵı�����Һ�� t3�����µ� t2����������Һ�����ʵ�����������ͬ
D.�� 20%�ļ���Һ���� 220g ������������Ϊ 10%�ļ�ϡ��Һ����Ҫ��ˮ������Ϊ 60g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
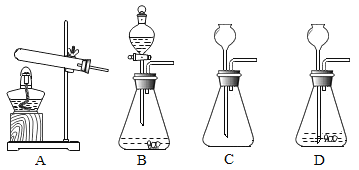
����Ŀ�������Ǽ���ʵ������ȡ����ķ���װ�ú��ռ�װ�á���ش��������⣺
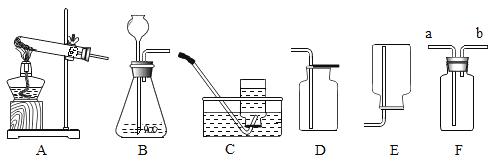
��1��ʵ����������غͶ���������ȡ����ʱӦѡ��_____________������ĸ��ţ���ͬ������װ�ã���Ҫ�ռ���Ϊ�������������ѡ��___________װ�ã�ֹͣ����ʱ����Ҫ��________________,��Ϩ��ƾ��ơ�
��2��ʵ������ȡ������п����ϡ���ᣬ��ѡ�õķ���ʵ��װ����____________�������ܶȱȿ���С��������ˮ���ռ�����װ��_________________��
��3��װ��F��һ�ֿ����ڼ�����ϴ���ȵĶ��װ�á�����Fװ����װ��ˮ����������Ͳ���Ϳ������ڲⶨ������ˮ�Ҳ���ˮ��Ӧ�����������������Ӧ��___________���a����b��������F�С�
��4��ʵ�������ÿ�״����̼���ƺ�ˮ��Ӧ��ȡ��Ȳ��C2H2�����÷�Ӧ�dz������ҷų��������ȣ���ѡ����װ������ʵ���______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��F�dz��л�ѧ������6�����ʣ��ֱ���Cu��Ba��Na��H��C��O��S��Cl�е����ֻ�����Ԫ����ɡ�A�Ĺ�̬�������˹����꣬C���ʺ�NaԪ�أ�E����Һ����ɫ��E��F��Ӧ��������Ϊ���ֳ��������ʼ�Ĺ�ϵ��ͼ��ʾ��ע��ͼ�в��ַ�Ӧ��������Ѻ��ԣ���������ʾ��Ӧ��ϵ����������ʾת����ϵ������ش��������⣺
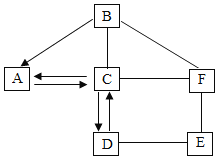
��1��A�Ĺ�̬����___________��
��2��B��Һ��ʹ��ɫʯ����Һ��_______ɫ��
��3��д��C��F�Ļ�ѧʽ��C____________��F___________��
��4��д��D��E��Ӧ�Ļ�ѧ����ʽ��________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʦ����ѧ��̽���������غ㶨�����Ľ�ѧƬ�Σ��������̽������æ��д�ո�
��������⣩��ѧ��Ӧǰ������ʵ������ܺ��Ƿ���ȣ�
����������裩�������ȣ� ��������;
��ʵ��̽�����ס�������ͬѧ��������ƽ�ֱ������Ӧǰ�����ʵ�������
�� �� | �� �� | |
ʵ�鷽�� ����Ӧ���ԣ� |
|
|
ʵ������ | �����ݲ�������ƽָ������ƫת | ���������к�ɫ������������Һ��ɫ�����ı䣬��ƽָ��û��ƫת |
���� | �������ȷ | �������ȷ |
����˼���ۣ��������ֲ�����ȷ��ͨ�����ۣ�ͬѧ�Ƿ��ּ��������������������ָ������ƫת���õ���ʾ����̽����ѧ��Ӧǰ������ʵ������ܺ��Ƿ����ʱ���������������ɻ�μӵķ�Ӧһ��Ҫ��____�н��С�
���Ż�װ�ã�ͬѧ�ǶԼ��������еķ�Ӧװ�ý������������ָĽ�������Ϊ���װ����_____������
�ţ�������������װ������ѡһ��ָ���䲻��__________��
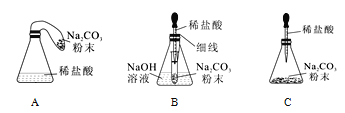
���ó����ۣ�ͬѧ�����øĽ�������װ�ý����ٴ�̽�������ó��������ȷ����һ���������֣���Ӧ��ϵ�����ĺ�δ�μӷ�Ӧ�����ʵ������ڷ�Ӧǰ�ֲ��䣬���յó������ǣ��μӻ�ѧ��Ӧ�ĸ����ʵ������ܺ͵��ڷ�Ӧ�����ɵĸ����ʵ������ܺ͡�
������Ӧ�ã����ͣ���ѧ��Ӧǰ��ԭ�ӵ����ࡢ��Ŀ�����������䣬���������غ㡣
Ӧ�ã�ij�����������Ȼᷢ���ֽⷴӦ����������ͭ��ˮ�Ͷ�����̼�������ʣ���ù�������һ����_______��Ԫ����ɡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CO��CO2�Ļ������10g���ڸ����»���ͨ�����������������ٰѵõ�������ͨ�������ij���ʯ��ˮ�У����ˡ�����õ�30g��ɫ��������ԭ���������CO �� CO2��������Ϊ
A.14��11B.7��11C.2��1D.1��2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com