
| 实验 | 第一次 | 第二次 | 第三次 |
| 取用石灰石的质量/g | m | m | m |
| 取用稀盐酸的质量/g | 30 | 60 | 90 |
| 反应后过滤得到固体的质量(已干燥)/g | 6 | 2 | 1 |
| 10g-10g |
| 10g |
| 100 |
| 73 |
| 4g |
| x |
| 2.97g |
| 30g |


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:初中化学 来源: 题型:
| 样品 | 第1份 | 第2份 | 第3份 | 第4份 |
| 取样品质量(g) | 6.0 | 6.0 | 6.0 | 6.0 |
| 取稀硫酸质量(g) | 10.0 | 20.0 | 30.0 | 40.0 |
| 产生气体质量(g) | 0.88 | 1.76 | 2.2 | m |
查看答案和解析>>
科目:初中化学 来源: 题型:
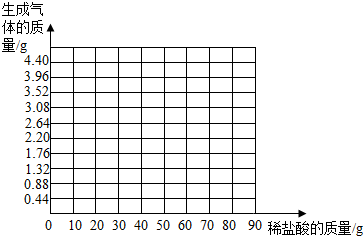
| 盐酸的质量(g) | 10 | 20 | 40 | 60 | 80 |
| 二氧化碳的质量(g) | 0.88 | 1.76 | 3.52 | 4.4 | X |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验次数 | 1 | 2 | 3 | 4 | 5 |
| 每次加入盐酸量/g | 5.0 | 5.0 | 5.0 | 5.0 | 5.0 |
| 剩余固体质量/g | 1.5 | 1.0 | 0.5 | 0.4 | 0.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验 | 第一次 | 第二次 | 第三次 |
| 取用石灰石的质量/g | m | m | m |
| 取用稀盐酸的质量/g | 30 | 60 | 90 |
| 反应后过滤得到固体的质量(已干燥)/g | 6 | 2 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com