
分析 根据质量守恒定律,混合物质量的减少的质量即生成的氢气质量,据此根据反应的化学方程式列式计算出参加反应锌和硫酸的质量,进而计算出锌的纯度、稀硫酸溶液中溶质的质量分数.
解答 解:(1)由质量守恒定律,生成氢气的质量为7g+100g-106.8g=0.2g.
(2)设参加反应的锌的质量为x,参加反应的硫酸的质量为y,
Zn+H2SO4═H2↑+ZnSO4
65 98 2
x y 0.2g
$\frac{65}{2}=\frac{x}{0.2g}$ x=6.5g
锌的纯度为$\frac{6.5g}{7g}×$100%≈92.9%.
(3)$\frac{98}{2}=\frac{y}{0.2g}$ y=9.8g
稀硫酸溶液中溶质的质量分数为$\frac{9.8g}{100g}×$100%=9.8%.
答:(1)氢气的质量为0.2g;(2)锌的纯度为92.9%;(3)稀硫酸溶液中溶质的质量分数为9.8%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出氢气的质量是正确解答本题的前提和关键.


科目:初中化学 来源: 题型:解答题
| 实验编号 | 实验药品 | 分解温度(℃) |
| ① | KClO3 | 580 |
| ② | KClO3、MnO2(质量比1:1) | 350 |
| ③ | KClO3、CuO(质量比1:1) | 370 |
| ④ | KClO3、Fe2O3(质量比1:1) | 390 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验 | 实验一 | 实验二 | 实验三 |
| 实验方案 |  | 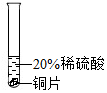 | 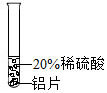 |
| 实验现象 | 铬片表面产生气泡缓慢,溶液变为蓝色 | 无明显现象 | 铝片表面产生气泡较快 |
| 结论 | 铬能与稀硫酸反应,反应速率较慢 | 铜不与稀硫酸反应 | 铝能与稀硫酸发生反应,反应速率较快 |
| 三种金属在金属活动性顺序中的相对位置关系是Al>Cr>Cu. | |||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 反应前容器内空气体积 | 反应后容器内气体体积 |
| 30mL | X mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com