
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
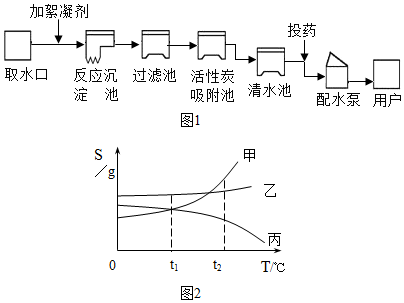
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Fe2+:一个铁离子带2个单位的正电荷 | |
| B. | 2 N:2个氮原子 | |
| C. | $\stackrel{+2}{Mg}$:正二价的镁元素 | |
| D. | SO2:一个二氧化硫分子中含有2个氧原子 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫在氧气中燃烧,发出淡蓝色火焰,生成无色气体. | |
| B. | 磷在空气中燃烧,产生大量白雾. | |
| C. | 铁丝在氧气中剧烈燃烧、火星四射、生成黑色固体 | |
| D. | 木炭在氧气中燃烧时,发出白光,生成黑色固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | H2O2=(MnO2)=H2↑+O2↑ | B. | 2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO | ||
| C. | FeSO4+Cu=CuSO4+Fe | D. | Na2CO3+HCl=NaCl+H2O+CO2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 茶氨酸由C、H、O、N四种元素组成 | |
| B. | 每个茶氨酸分子含有26个原子 | |
| C. | 茶氨酸中碳元素与氢元素的质量比为6:1 | |
| D. | 茶氨酸是由7个碳原子、14个氢原子、3个氧原子和2个氮原子构成 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com