
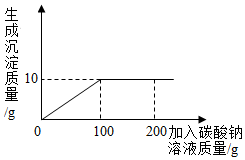
 Ϊ�ⶨ���Ȼ��ƺ��Ȼ�����ɵĹ�����Ʒ���Ȼ��Ƶĺ�����ijͬѧ����������ʵ�飺ȡ14�˹�����Ʒ��ȫ������100��ˮ�У������õĻ����Һ�еμ�������������Ϊ10.6%��̼������Һ����¼����������ͼ��ʾ������
Ϊ�ⶨ���Ȼ��ƺ��Ȼ�����ɵĹ�����Ʒ���Ȼ��Ƶĺ�����ijͬѧ����������ʵ�飺ȡ14�˹�����Ʒ��ȫ������100��ˮ�У������õĻ����Һ�еμ�������������Ϊ10.6%��̼������Һ����¼����������ͼ��ʾ���������� ��1���������ʵĹ�����������д��
��2����ͼ�������
��3������̼��Ƶ������Ͷ�Ӧ�Ļ�ѧ����ʽ�����Ȼ��Ƶ����������������Ӧ������������
��� �⣺
��1���Ȼ������������Ӻ������ӹ��ɵģ�����д��������Ҳ����д���ӵķ��ţ�
��2����ͼ���Կ������ɵij���Ϊ10g����Ӧ����Ϊ̼��ƣ�
��3�����Ȼ��Ƶ�����Ϊx
Na2CO3+CaCl2�TCaCO3��+2NaCl
111 100
x 10g
$\frac{111}{100}$=$\frac{x}{10g}$
x=11.1g
��Ʒ���Ȼ��Ƶ���������Ϊ$\frac{11.1g}{14g}$��100%��79.3%
�𣺣�1�������Ȼ��Ƶ����� �����Ӻ������ӣ�Na+��Cl-����
��2�����Ȼ�����̼����ǡ����ȫ��Ӧʱ�����ó���������Ϊ10�ˣ�
��3����Ʒ���Ȼ��Ƶ�����������49.3%��
���� ���ݻ�ѧ����ʽ����ʱ����һҪ��ȷ��д��ѧ����ʽ���ڶ�Ҫʹ����ȷ�����ݣ������������Ҫ������


 ���Ŀ����ϵ�д�
���Ŀ����ϵ�д� ������ӱ������ͯ������ϵ�д�
������ӱ������ͯ������ϵ�д� A�ӽ��� ϵ�д�
A�ӽ��� ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ�� | B�� | Ԫ�� | C�� | ���� | D�� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
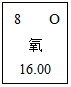 ��ͼ��Ԫ�����ڱ�����Ԫ�ص���Ϣʾ��ͼ�������й�����˵��������ǣ�������
��ͼ��Ԫ�����ڱ�����Ԫ�ص���Ϣʾ��ͼ�������й�����˵��������ǣ�������| A�� | ���ǵؿ��к�����ߵķǽ���Ԫ�� | |
| B�� | ��ԭ�ӵ����ԭ������Ϊ16.00 | |
| C�� | ��ԭ�ӵ�������Ϊ8 | |
| D�� | �����ڿ�������ռ��������ԼΪ21% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʳƷ���ʴ��г��뵪��������Ч�����ͱ��� | |
| B�� | ϡ������Ļ�ѧ���ʲ����ã������������������ں��ӽ���ʱ���ڸ������� | |
| C�� | ���������̼���ֳƸɱ����������˹����� | |
| D�� | ����ȼ��ʱ�����ĸ��»���������и�ӽ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
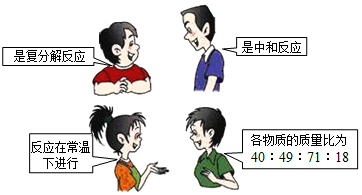
| A�� | 2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$ 2H2O+O2�� | B�� | Na2CO3+Ca��OH��2=CaCO3��+2NaOH | ||
| C�� | C2H5OH+3O2$\frac{\underline{\;��ȼ\;}}{\;}$2CO2+3H2O | D�� | 2NaOH+H2SO4=Na2SO4+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
 С��ͬѧΪ�ⶨ��̼��Ƶĺ�����ע�Ƿ���ʵ����ȡ��4ƬƬ�������������ձ��У���μ���ϡ���ᣬ�����ٷų�����Ϊֹ������ȥϡ����40.0g�������ձ���ʣ��������Ϊ47.8g�������ձ��������ٶ���Ƭ�����ɷֲ���
С��ͬѧΪ�ⶨ��̼��Ƶĺ�����ע�Ƿ���ʵ����ȡ��4ƬƬ�������������ձ��У���μ���ϡ���ᣬ�����ٷų�����Ϊֹ������ȥϡ����40.0g�������ձ���ʣ��������Ϊ47.8g�������ձ��������ٶ���Ƭ�����ɷֲ����鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com