

| 实验内容 | 预测现象 | 结论 |
| 实验一:取一定量残留固体于试管中,加热一段时间后,冷却,称量 | 加热前后固体质量减少(“不变”或“减少”). | 含有碳酸氢钠 |
| 实验二:取适量残留固体于试管中,加放蒸馏水充分振荡,滴入氯化钙溶液. | 溶液中产生白色沉淀 | 含有碳酸钠 |
| 结合实验一和实验二得出,猜想3正确. | ||
分析 (1)浓硫酸具有吸水性,可以用来干燥二氧化碳,氧气能够支持燃烧;
(2)根据碳酸钠和碳酸氢钠的性质以及反应的实验现象确定物质的成分;
(3)根据碳酸氢钠受热易分解解答.
解答 解•:(1)浓硫酸具有吸水性,能吸收碳酸氢钠受热分解产生的水蒸气;
观察图乙中的现象是蚊香燃烧更剧烈,说明有氧气产生,即过氧化钠和二氧化碳反应生成了氧气;
甲中和过氧化钠混合的二氧化碳是干燥的,不容易和过氧化钠反应,因此没有反应的二氧化碳能使燃烧的蚊香熄灭,而乙中的二氧化碳中含有水蒸气,容易和过氧化钠反应生成氧气,由资料和实验可得出的结论是湿润的二氧化碳更容易和过氧化钠反应;
故填:干燥二氧化碳;蚊香燃烧更剧烈;湿润的二氧化碳更容易和过氧化钠反应;
(2)碳酸氢钠可能是部分分解,故残留的固体可能是碳酸钠和碳酸氢钠的混合物,故填:有碳酸钠和碳酸氢钠;
取一定量残留固体于试管中,加热一段时间后,冷却,称量,由于含有碳酸氢钠,碳酸氢钠受热会分解生成二氧化碳和水蒸气逸出,故固体质量会减少;含有碳酸钠,则碳酸钠能与氯化钙反应生成碳酸钙白色沉淀,故猜想3正确;故填:
| 实验内容 | 预测现象 | 结论 |
| 实验一:取一定量残留固体于试管中,加热一段时间后,冷却,称量 | 加热前后固体质量 减少(“不变”或“减少”). | 含有碳酸氢钠 |
| 实验二:取适量残留固体于试管中,加放蒸馏水充分振荡,滴入 氯化钙溶液. | 溶液中 产生白色沉淀 | 含有碳酸钠 |
| 结合实验一和实验二得出,猜想 3正确. | ||
点评 本题考查的是碳酸氢钠和碳酸钠性质的实验探究,完成此题,可以依据已有的物质的性质结合物质间反应的实验现象进行.


科目:初中化学 来源: 题型:实验探究题
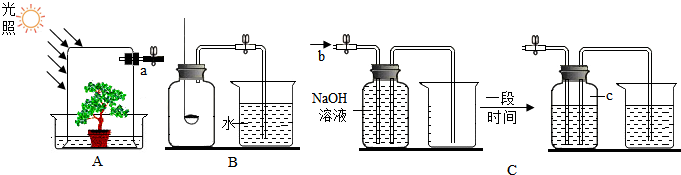
| 实验步骤 | 实验现象 | 实验结论 |
| 抽取适量气体,注入石灰水中 | 澄清石灰水变浑浊 | 玻璃罩内含有二氧化碳. |
| 发生的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O | ||
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 冰雪融化、光合作用 | B. | 发光放热、食物易腐败 | ||
| C. | 电解水、氢气有可燃性 | D. | 汽油挥发、钢铁易生诱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com