
【题目】一凡同学对生铁的组成进行研究,称取生铁样品 40g,把 500g 稀硫酸分 5 次加入样品中, 测得实验数据见下表:(杂质不溶于水,也不和稀硫酸反应)
实验序号 | 加入稀硫酸的质量/g | 剩余固体的质量/g |
第 1 次 | 100 | 28.8 |
第 2 次 | 100 | 17.6 |
第 3 次 | 100 | M |
第 4 次 | 100 | 1.2 |
第 5 次 | 100 | N |
(1)第 3 次剩余固体的质量 M=_____第 5 次剩余固体的质量 N=_____
(2)该生铁样品中铁的质量分数为_____。
(3)计算第 3 次反应结束后所得溶液的溶质质量分数。_____(写出计算过程,保留一位小数)
【答案】6.4 1.2 97% 27.4%
【解析】
(1)每100g的硫酸完全反应,反应掉的铁的质量是11.2g,由于在第4次时剩余混合物的质量总共有1.2g,由于17.6g-1.2g=16.4g,11.2g<16.4g<11.2g×2,所以第3次硫酸完全反应,剩余固体的质量为17.6-11.2g=6.4g;第4次硫酸有剩余,剩余固体不再与硫酸反应,第五次剩余的杂质是1.2g,所以M=6.4,N=1.2,故填:6.4;1.2。
(2)该生铁样品中铁的质量分数为:![]() =97%;
=97%;
(3)设第3次反应结束后得溶液的FeSO4溶质质量为x,产生氢气的质量为y。反应掉的铁的质量为:40g-6.4g=33.6g。
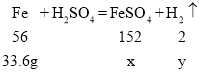
![]()
解得:x=91.2g;y=1.2g。
得溶液的溶质质量分数为:![]() 。
。
答:第 3 次反应结束后所得溶液的溶质质量分数为27.4%。故填:27.4%。


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:初中化学 来源: 题型:
【题目】化学兴趣小组在实验室用大理石与4%的稀盐酸做二氧化碳制取实验,请你写出发生反应的化学方程式________________。当观察到试管中不再产生气泡时,发现固体还有剩余,小组同学对此进行探究( 杂质不溶于水且不与酸反应)。
[提出问题]不再产生气泡的原因是什么?
[查阅资料]氯化钙溶液显中性。
[作出猜想]
猜想1:盐酸已经完全反应。
猜想2:剩余固体中无碳酸钙。
猜想3:生成物或杂质附着在大理石表面,阻碍反应继续进行。
[实验一]探究反应后的溶液中是否有盐酸
(1)取上述反应后的清液,测得溶液pH=3,说明该溶液显_____________性,由此得出猜想1不成立的结论。
有的同学对此提出质疑,认为此结论不严谨,你认为这样质疑的理由是______。同学们经过讨论,一致认为通过实验1得出的结论不严谨,还需要通过完成实验2才能得出结论。
(2)另取洁净的试管,________________,测得溶液pH=5.6。
[得出结论]猜想1不成立。
[实验二]探究剩余固体中是否有碳酸钙
先振荡反应容器,使剩余固体与液体充分接触,发现仍无气泡产生,向容器中滴加少量4%的稀盐酸,发现又有气泡产生,且不再产生气泡时,仍有固体剩余。
[得出结论]猜想_______________不成立。
[分析讨论]综合实验一和实验二,导致气泡不再产生的原因是________________。
[反思提升](1)反应物的浓度也是影响反应能否进行的因素。(2)在探究反应后溶液显酸性或碱性的问题时,应注意的问题是________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验小组做了如下图所示实验。
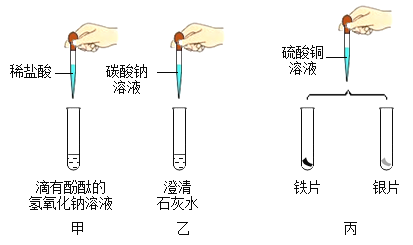
(1)能证明甲中发生反应的现象是_____。
(2)乙中可观察到的现象是_____,发生反应的化学方程式为_____。
(3)丙中观察到的现象为_____, 由该实验现象推断,三种金属活动性由强到弱为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氨基钠(NaNH2)常用于医药制造,根据其性质,氨基钠应该用时制备,不要长时间贮存。工业上制取氨基钠是将钠于97~100℃熔融,向反应容器中缓慢通入无水液氨(NH3),再加热至350~360℃,生成氨基钠和氢气。下列说法中,不正确的是( )
A. 氨基钠的化学性质稳定
B. 将钠于97~100℃熔融属于物理变化
C. 制取氨基钠的反应方程式为:2Na + 2NH3 ![]() 2NaNH2+H2↑
2NaNH2+H2↑
D. 通入无水液氨的原因是,钠可能与水反应
查看答案和解析>>
科目:初中化学 来源: 题型:
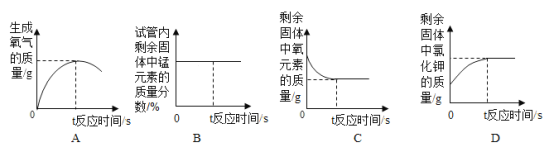
【题目】下列图像不能正确反映对应变化关系的是( )
|
|
|
|
A向一定量的稀盐酸中滴加氢氧化钠 溶液 | B将等质量的镁片和铁片投入到足量稀H2SO4 中 | C室温时,向一定量的稀盐酸中加入 少量镁条 | D向饱和的 Ca(OH)2溶液中加入一定量的CaO 固体 |
A.AB.BC.CD.D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室利用如图所示装置进行相关实验。
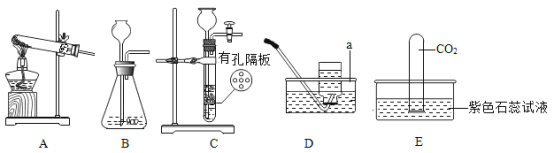
(1)装置D中仪器a的名称是_____。
(2)用一定量氯酸钾和二氧化锰混合加热制取氧气时。
Ⅰ.反应的化学方程式为_____,反应类型是_____ (填“化合”或“分解”)反应。
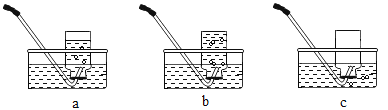
Ⅱ.下图是用D装置收集氧气的过程,依次观察到的现象是_____ (用字母表示)
Ⅲ.实验结束后,经过溶解、_____、 洗涤、 烘干等操作回收二氧化锰。
Ⅳ. 反应过程中,能正确表示对应变化关系的图像是_____(填字母编号)。
(3)用块状大理石和稀盐酸制取二氧化碳时。
Ⅰ.可选用发生装置B或_____(填编号);在装置B中依次添加大理石、盐酸,添加盐酸时从长颈漏斗中倒入锥形瓶至_____。
Ⅱ.将收集满二氧化碳气体的试管倒插入紫色石蕊试液中(见上图E装置),并轻轻振荡试管。产生的现象是_____; 反应的化学方程式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向一定量的硝酸铜、硝酸亚铁的混合溶液中加入 2.4g 镁粉,充分反应后过滤、洗涤、 干燥,称得固体 6g。则下列分析正确的是( )
A.滤液中一定不含有硝酸铜B.滤液中一定含有硝酸亚铁
C.滤出的固体中可能有铜无铁D.滤出的固体中可能只有铜和镁
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属是一种非常重要的资源,在生产、生活中有着广泛的用途.
(1)人类每年从自然界提取大量的金属,其中提取量最大的是铁.用赤铁矿和一氧化碳炼铁的化学方程式为_____.
(2)央视315晚会曝光某品牌汽车厂为了节约成本,采用价格相对便宜的普通钢板代替防腐性能较好的镀锌板,造成钢板生锈,给车主带来极大安全隐患.普通钢板在空气中锈蚀,实际上是铁跟空气中的_____共同作用的结果.
(3)请写出工业上用稀硫酸除铁锈的化学反应方程式_____.
(4)亮亮同学用稀盐酸和另一种溶液,验证了Mg、Fe、Cu、Ag四种金属的活动性顺序是依次减弱的.请问亮亮所用的另一种溶液是_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铁是当今世界上应用最广泛的金属
(1)铁与潮湿的空气接触易生锈。对铁锈蚀的影响因素进一步探究如下:
组别 | 1 | 2 | 3 | 4 | 5 |
图示 |
|
|
|
|
|
生锈时间 | 8min | 较长时间不生锈 | 5min | 3min | 1min |
通过上述第_____组对比实验能证明温度越高,铁钉生锈的速率越快。利用上述实验,还可得出的结论是_____。
(2)实验室以Fe2O3为原料模拟炼铁的化学方程式为_____。
(3)以Fe2O3为原料制备合成氨工业生产中所需的a-Fe催化剂(主要成分FeO、Fe2O3),原理为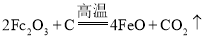 。当催化剂中FeO与Fe2O3的质量之比为9:20时,其催化活性最高。此时Fe2O3的转化率为_____( 精确到1%)。
。当催化剂中FeO与Fe2O3的质量之比为9:20时,其催化活性最高。此时Fe2O3的转化率为_____( 精确到1%)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com