


科目:初中化学 来源: 题型:
 (2009?宁德)(1)用化学用语表示:
(2009?宁德)(1)用化学用语表示: 生产“达菲”的主要原料是莽草酸(如右图所示,莽草酸的化学式为C2H2O5).请根据信息回答:
生产“达菲”的主要原料是莽草酸(如右图所示,莽草酸的化学式为C2H2O5).请根据信息回答:查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
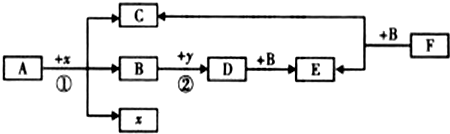
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
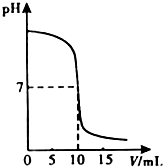 (2009?宁德)中和反应在日常生活和工农业生成中有广泛的应用.在一次化学探究活动中,同学们用一定体积10%的盐酸和一定体积10%的氢氧化钠溶液发生反应.下图表示的是溶液的pH与加入溶液的一定体积变化关系曲线.
(2009?宁德)中和反应在日常生活和工农业生成中有广泛的应用.在一次化学探究活动中,同学们用一定体积10%的盐酸和一定体积10%的氢氧化钠溶液发生反应.下图表示的是溶液的pH与加入溶液的一定体积变化关系曲线.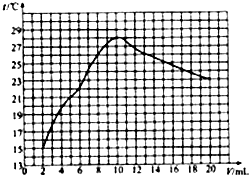
查看答案和解析>>
科目:初中化学 来源: 题型:
| 物质 | NaCl | Na2CO3 | NaHCO3 |
| 溶解度/g | 35.9 | 21.5 | 9.6 |
| 实验步骤 | 实验现象 | 实验结论 |
取少量粉末于试管中,向里滴加稀盐酸 取少量粉末于试管中,向里滴加稀盐酸 |
有气泡生成 有气泡生成 |
该溶液是Na2CO3溶液 |
| 1 |
| 10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com