
分析 (1)根据人体营养素进行分析;
(2)活性炭的作用是吸附水中的色素和异味;
(3)用肥皂水可以检验水的软硬;
(4)根据淀粉遇碘水变蓝进行分析;
(5)根据量筒读数的方法进行分析判断.
解答 解:(1)水属于人体的六大类营养素.
(2)净化水的过程中,主要是利用其活性炭的吸附作用.
(3)向水中加入肥皂水时,如果产生的泡沫较多是软水;如果产生的泡沫很少或不产生泡沫,说明是硬水;可以用肥皂水来检验水的软硬加肥皂水,泡沫少,浮渣多为硬水,反之为软水.
(4)淀粉中滴加碘水,呈蓝色,因此碘水可检验某食品中是否含淀粉.
(5)配制稀硫酸时,仰视读取量筒中的浓硫酸体积,量取的浓硫酸的体积偏大,所配稀硫酸的质量分数偏大.
故答案为:(1)属于;
(2)吸附;
(3)肥皂水;
(4)淀粉;
(5)偏大
点评 化学与我们的生活息息相关,本题难度不大,掌握常见物质的性质和用途即可正确解答本题.


科目:初中化学 来源: 题型:解答题
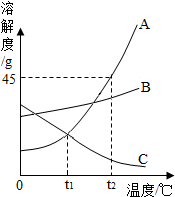 如图是A、B、C三种物质的溶解度曲线,我能根据此图回答下列问题:
如图是A、B、C三种物质的溶解度曲线,我能根据此图回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
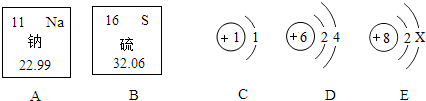
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 实验序号 | 加入水的体积 | 加入水的温度 | 收集到的气体的体积 |
| 1 | 200mL | 15℃ | a(待记录) |
| 2 | 200mL | 50℃ | b(待记录) |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 项目 | 标准 |
| 感官指标 | 无异味、异臭等 |
| 化学指标 | pH6.5-8.5,铜<1.0mg•L-1,氟化物<1.0mg•L-1,游离氯≥0.3mg•L-1等 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 0.8g | B. | 1.6g | C. | 3.2g | D. | 6.4g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
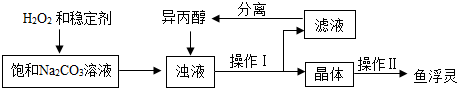
| 温度范围/℃ | 5~10 | 10~15 | 15~20 | 20~25 |
| 活性氧含量/% | 13.94 | 14.02 | 15.05 | 14.46 |
| “鱼浮灵”的产率/% | 85.49 | 85.78 | 88.38 | 83.01 |
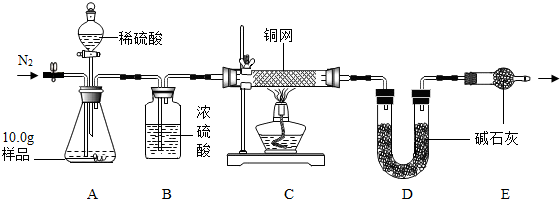
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
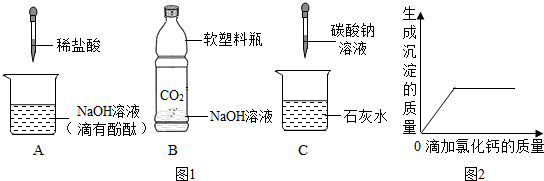
| 学生甲 | 还可能有Ca(OH)2、NaOH | 学生丙 | 还可能有Ca(OH)2、CaCl2 |
| 学生乙 | 还可能有NaOH、Na2CO3 | 学生丁 | 还可能有Na2CO3 |
| … | … |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com