
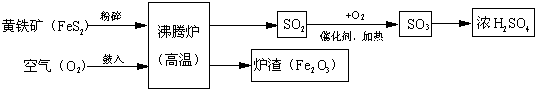
分析 (1)氧化物是由两种元素组成,一种元素是氧元素的化合物;黄铁矿粉碎会增大反应物的接触面积加快反应速度;(2)根据流程图中的反应物和生成物结合方程式的书写进行分析;(3)根据流程图中的反应物和生成物结合方程式的书写解答;(4)根据浓硫酸的稀释方法考虑;(5)根据氧化铁可以用来炼铁考虑;
解答 解:(1)二氧化硫或三氧化硫或三氧化二铁都是由两种元素组成,一种元素是氧元素,属于氧化物;增大反应物接触面积越大,反应越剧烈,黄铁矿粉碎会增大反应物的接触面积,加快反应速度;
(2)根据流程图FeS2和氧气反应产生二氧化硫和氧化铁,故反应的方程式为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;
(3)反应物是二氧化硫和氧气,生成物是三氧化硫,用观察法配平,反应条件是催化剂和加热,所以方程式是:2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3;
(4)浓硫酸的稀释方法是:将浓硫酸沿着容器壁慢慢倒入水中,并用玻璃棒不断搅拌;
(5)炉渣(Fe2O3)可以用来炼铁,一氧化碳与氧化铁反应生成铁和二氧化碳,所以可以用做冶铁原料.
故答案为:
(1)二氧化硫或三氧化硫或三氧化二铁;增大反应物的接触面积;
(2)4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;
(3)2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3;
(4)将浓硫酸沿着容器壁慢慢倒入水中,并用玻璃棒不断搅拌;
(5)炼铁
点评 解答本题的关键是要知道氧化物的特点,知道反应物接触面积越大,反应越剧烈,熟悉方程式的书写注意事项,知道浓硫酸的稀释方法.


科目:初中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验 目的 | 鉴别N2和CO2 | 证明长期露置的氢氧化钠溶液已变质 | 鉴别硝酸钾和氯化铵 | 除去CaCl2溶液中的HCl |
| 方案一 | 用燃着的木条 | 加稀盐酸 | 看外观 | 加过量碳酸钙 |
| 方案二 | 加紫色石蕊溶液 | 加澄清石灰水 | 加硝酸银溶液 | 加过量氧化钙 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 纯净物M、N之间存在着如图所示转化关系,且反应物和生成物均表示在图示中.单质A和单质B分别由A、B元素组成.据此,以下说法中正确的是( )
纯净物M、N之间存在着如图所示转化关系,且反应物和生成物均表示在图示中.单质A和单质B分别由A、B元素组成.据此,以下说法中正确的是( )| A. | M可能是氧化物 | B. | M、N中只有N含有A元素 | ||
| C. | N一定不是氧化物 | D. | M与镁的反应一定是置换反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
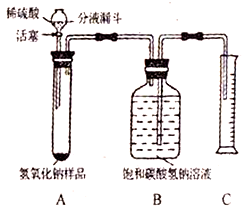 实验室有一瓶长期暴露在空气中已变质的氢氧化钠固体样品,某兴趣小组的同学对该样品的碳酸钠含量进行了探究.
实验室有一瓶长期暴露在空气中已变质的氢氧化钠固体样品,某兴趣小组的同学对该样品的碳酸钠含量进行了探究.查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 观察到的现象 | 结论 |
| (1)取上述试管中的上层清液,滴加1~2滴无色酚酞试液 | 酚酞溶液不变红 | 碳酸钙 |
| (2)往上述试管内残留的固体中加入稀盐酸 | 由气泡生成 | 白色粉末中含有碳酸钙 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com