
| A. | 氧化汞受热分解 HgO2 $\frac{\underline{\;\;△\;\;}}{\;}$Hg+O2↑ | |
| B. | 红磷在氧气中燃烧 P+O2$\frac{\underline{\;点燃\;}}{\;}$P2O5 | |
| C. | 铁丝在氧气中燃烧 3Fe+2O2 $\frac{\underline{\;点燃\;}}{\;}$Fe3O4 | |
| D. | 电解水 2H2O═2H2↑+O2↑ |
分析 根据化学方程式判断正误的方法需考虑:应用的原理是否正确;化学式书写是否正确;是否配平;反应条件是否正确;↑和↓的标注是否正确.
解答 解:A、氧化汞的化学式错误,反应的化学方程式是:2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑.
B、该化学方程式没有配平,正确的化学方程式应为:4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.
C、该化学方程式书写完全正确;
D、缺少反应条件,正确的化学方程式为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
故选:C
点评 本题难度不大,在解此类题时,首先分析应用的原理是否正确,然后再根据方程式的书写规则进行判断;化学方程式正误判断方法是:先看化学式是否正确,再看配平,再看反应条件,再看气体和沉淀,最后短线改成等号.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
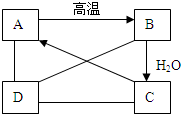 有A、B、C、D四种物质,如图所示,A、B、C、D在一定条件下可以转化,在C溶液中通入二氧化碳气体,溶液变浑浊,生成白色沉淀A.D与A、B、C均能发生反应,D与C发生中和反应,D与A反应有二氧化碳气体产生,D与硝酸银溶液反应可产生不溶于稀硝酸的白色沉淀.
有A、B、C、D四种物质,如图所示,A、B、C、D在一定条件下可以转化,在C溶液中通入二氧化碳气体,溶液变浑浊,生成白色沉淀A.D与A、B、C均能发生反应,D与C发生中和反应,D与A反应有二氧化碳气体产生,D与硝酸银溶液反应可产生不溶于稀硝酸的白色沉淀.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
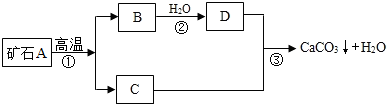
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
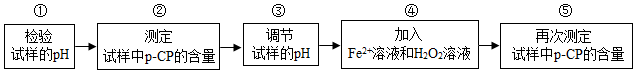
| 实验编号 | 温度/℃ | pH | 测得p-CP的含量随时间变化的关系图 |
| a | 25 | 10 | 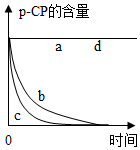 |
| b | 25 | 3 | |
| c | 40 | 3 | |
| d | 40 | 10 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ${\;}_{Al}^{+3}$---1个铝离子带3个单位正电荷 | |
| B. | 2H2O---2个水分子 | |
| C. | 2H---两个氢元素 | |
| D. | Ca2+---钙元素的化合价为+2价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com