
【题目】(5分)小坊同学在实验室用一定量的氯酸钾和二氧化锰混合物制取氧气,加热至固体质量不再减少时,称得固体残渣质量为20.4 g,为了分离出二氧化锰,她向残渣中加入40℃的水30 g,充分溶解,第一次过滤后得到滤液A和8.4 g残渣,她又向残渣中加入40℃ 的水l0 g,充分溶解,第二次过滤后得到滤液B和5.5 g残渣(假设在实验过程中无损失)。请回答下列问题:
(1)反应的化学方程式为 ___________________________
(2)8.4 g残渣的成分是_______;
(3)利用已知条件列出求原混合物中氯酸钾质量(X)的比例式______ :
(4)将滤液A和滤液B混合,并加入45.1g水,求所得溶液的溶质质量分数______ :
(5)原固体混合物中氯酸钾和二氧化锰的质量比为___________________________。
(已知:40℃ 时,氯化钾的溶解度为40 g)
【答案】(1)2KClO3 ![]() 2KCl + 3O2 ↑ (2)KCl MnO2
2KCl + 3O2 ↑ (2)KCl MnO2
(3)245/149==X/14.9 g (4)14.9% (5)49:11
【解析】
试题分析:(1) 实验室用一定量的氯酸钾和二氧化锰混合物制取氧气反应的化学方程式为:2KClO3 ![]() 2KCl + 3O2 ↑
2KCl + 3O2 ↑
(2)因为是加热至固体质量不再减少时,称得固体残渣质量为20.4 g,包括的物质是二氧化锰和氯化钾,根据她向残渣中加入40℃的水30 g,充分溶解,第一次过滤后得到滤液A和8.4 g残渣,说明30g溶解了12g氯化钾,她又向残渣中加入40℃ 的水l0 g,充分溶解,第二次过滤后得到滤液B和5.5 g残渣,按照前面的质量关系l0 g硬溶解4g氯化钾,所以应该剩余固体质量=8.4g-4g=4.4g<5.5g,说明5.5 g残渣中没有氯化钾,只有二氧化锰,而8.4 g残渣的成分是KCl 和MnO2
(3)根据上面的分析,二氧化锰质量=5.5g,故氯化钾质量=20.4g-5.5g=14.9g,再根据化学反应:2KClO3 ![]() 2KCl + 3O2 ↑中KClO3和KCl的质量关系245:149,可列出求原混合物中氯酸钾质量(X)的比例式:245/149==X/14.9 g
2KCl + 3O2 ↑中KClO3和KCl的质量关系245:149,可列出求原混合物中氯酸钾质量(X)的比例式:245/149==X/14.9 g
(4)将滤液A和滤液B混合,实际得到的就是氯化钾溶液,溶质氯化钾质量=14.9g,而溶液质量=30g+10g+45.1g+14.9g=100g, 故所得溶液的溶质质量分数=14.9g/100g×100%=14.9%
(5)通过第三问,可以求出氯酸钾质量=24.5g,而二氧化锰质量=5.5g,故原固体混合物中氯酸钾和二氧化锰的质量比=24.5g: 5.5g=49:11


科目:初中化学 来源: 题型:
【题目】学会劳动。
(1)打扫卫生。易拉罐和包装纸盒都属于 (填序号,下同)。
a.有害垃圾 b.可回收物 c.厨余垃圾 d.其他垃圾
(2)浇花施肥。下列物质中,能作氮肥的是 。
a.CO(NH2)2 b.K2SO4 c.K2CO3 d.Ca(H2PO4)2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是a、b两种固体物质的溶解度曲线,下列说法中正确的是( )
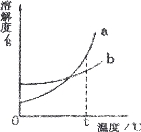
A.a中含有少量b时,一般用蒸发溶剂的方法提纯a
B.t℃时,a、b饱和溶液中含有的溶质质量a大于b
C.当温度大于t℃时,a溶液一定比b溶液浓
D.a物质的溶解度受温度变化的影响较大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(5分)现有A、B、C、D四瓶失去标签的白色粉末(纯净物),已知他们是硫酸铜、碳酸钠、氯化钠、硫酸钠中的一种。
【提出问题】如何鉴别四种物质? .
【设计实验】同学们最先想到的是把四种物质分别溶于水,观察溶液颜色。
【实验探究】取A、B、C、D四种白色粉末各一药匙,分别放入四支洁净的试管中,各加蒸馏水l0毫升,振荡后静置,只有盛放A的试管中的液体呈蓝色,其他呈无色。
为了鉴别其他三种物质,小香同学继续进行实验:
步骤一:向盛放B、C、D溶液的试管中加入等量的稀硫酸,只有C试管中有气泡冒出.
其他两支试管内均无明显现象:
步骤二:向步骤一实验后的盛有B、D溶液的两支试管中分别滴加氯化钡溶液,小香观察到的实验现象是(1)___________________________,产生该现象的原因是(_2__________________________;
【反思与交流】同学们经过分析讨论后,将小香的实验步骤(_3____)中所加入的(4)______改为(5)______(填名称),其他操作不变,发现B溶液中出现白色沉淀,于是将四种物质鉴别出来了;
【实验结论】(6)请将四种物质的化学式填在标签上。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】熟石灰的溶解度曲线如图所示。现将30℃时的1g熟石灰加入100g水中充分搅拌、过滤,不计溶液损失,再将得到的溶液降温到20℃.下列判断正确的是
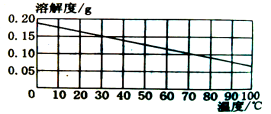
A.30℃时所得的溶液质量为101g
B.降温到20℃时溶质质量分数将变小
C.向熟石灰溶液中滴加紫色石蕊试液,熟石灰变蓝色
D.20℃时敞口静置一段时间后,则溶液表面会形成一层白膜。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(9分)过碳酸钠(2Na2CO3·3H2O2)广泛用于洗涤、纺织、医疗、造纸等。某兴趣小组展开了深入的学习:【资料卡片】:

I、制备研究:下图是制备过碳酸钠的工艺流程。
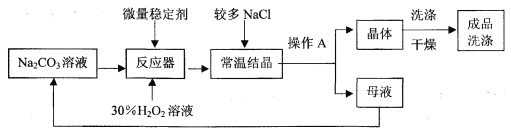
请回答问题:
(1)操作A的名称是 ,若在实验室完成此操作,需要的玻璃仪器是烧杯、玻璃棒和 。
(2)生产中,反应及干燥均需在较低温度下进行,原因是 。
(3)加入较多的氯化钠的作用是 。
Ⅱ、纯度测定:测定过碳酸钠样品(杂质不溶于水)中2Na2CO3·3H2O2的质量分数。
小组同学设计了如下图所示实验装置(部分仪器略去),并进行实验。

【实验步骤】:
①连接仪器,检查装置的气密性;
②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后
置于装置A中,在量筒中加满水;
③连接仪器,打开分液漏斗活塞,缓缓滴入水;
④待装置A中不再产生气泡时,停止加水,并关闭活塞;
⑤待量筒中水面不再变化时,记录其中水面刻度;
⑥根据数据进行计算。
【实验分析及数据处理】:
(4)实验中, ,则开始收集气体。
A.刚开始出现气泡时
B.当气泡均匀连续出现时
C.若用带火星木条放在导管口部,复燃时
(5)若量筒中收集到气体的体积是224mL(换算后质量约为0.32g),计算过碳酸钠样
品中2Na2CO3·3H2O2的质量分数为多少?[已知:Mr(2Na2CO3·3H2O2)=314,保留到0.1%
【反思】:
(6)量筒中长导管的作用是
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】a、b、c三种物质的溶解度曲线如右图所示。取等质量t2℃的a、b、c三种物质的饱和溶液,分别蒸发等量水后恢复至t2℃。下列说法不正确的是
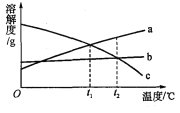
A.原饱和溶液中,溶质的质量分数:a>b=c
B.恢复至t2℃时,析出溶质的质量:a>b=c
C.恢复至t2℃时,三种溶液一定都是饱和溶液
D.若继续降温至t1℃,三种溶液一定都是饱和溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com