
| A. | MnO2发生了氧化反应 | |
| B. | H2O2发生了氧化反应 | |
| C. | H2O2发生了还原反应 | |
| D. | H2O2既发生了氧化反应,又发生了还原反应 |
分析 根据题意,在化学反应里,元素化合升高的物质发生氧化反应,元素化合价降低的物质发生还原反应.据此结合过氧化氢分解制取氧气的反应原理,进行分析判断.
解答 解:过氧化氢在二氧化锰的催化作用下生成水和氧气,H2O2中氢元素显+1价,设氧元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+2x=0,则x=-1价.水中氢元素显+1价,氧元素显-2价;单质中元素的化合价为0,O2属于单质,故氧元素的化合价为0.
A、MnO2作催化剂,没有发生氧化反应,故选项说法错误.
B、H2O2中氧元素显-1价,生成物水和氧气中氧元素分别显-2价、0价,氧元素的化合价既有升高,也有降低,既发生了氧化反应,又发生了还原反应,故选项错误.
C、H2O2中氧元素显-1价,生成物水和氧气中氧元素分别显-2价、0价,氧元素的化合价既有升高,也有降低,既发生了氧化反应,又发生了还原反应,故选项错误.
D、H2O2中氧元素显-1价,生成物水和氧气中氧元素分别显-2价、0价,氧元素的化合价既有升高,也有降低,既发生了氧化反应,又发生了还原反应,故选项正确.
故选:D.
点评 本题难度不大,了解氧化还原反应的特征(元素化合价升高的物质发生氧化反应,元素化合价降低的物质发生还原反应)并能灵活运用是正确解答本题的关键.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:选择题
| A. | 在蛋白质溶液中加入饱和硫酸铵溶液有沉淀析出 | |
| B. | “加铁酱油”中的“铁”指的是离子 | |
| C. | 通常把pH<7的降水称为酸雨 | |
| D. | 尿素〔CO(NH2)2〕及碳酸氢铵都是有机物 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
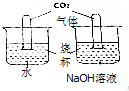 课外小组同学为探究二氧化碳的性质设计如图实验:
课外小组同学为探究二氧化碳的性质设计如图实验:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取适量电石加水反应,收集生成的气体,验纯后点燃. | 气体燃烧,产生黄色火焰并伴有浓烈黑烟. | 电石与水反应产生的气体是乙炔(或C2H2) |
| (2)取适量反应后生成的固体于试管中,滴加过量稀盐酸. | 固体溶解,没有气泡产生. | 电石与水反应产生的固体不是碳酸钙 |
| (3)取适量反应后生成的固体于试管中加水,向上层清液中滴加2~3滴酚酞. | 溶液变红 | 电石与水反应产生的固体是氢氧化钙 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 反应后铜的质量 | 反应后溶液的质量 | 初步结论 |
| 精确称量mg铜丝,然后放进ng氯化铁溶液中 | 小于mg(填大于、小于或等于) | 大于ng(填大于、小于或等于) | 铜能与氯化铁溶液发生反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验序号 | 滴加CuSO4溶液的量 | 实验现象 |
| ① | 第1~6滴 | 产生蓝色沉淀,但震荡后沉淀消失,形成亮蓝色溶液 |
| ② | 第7~9滴 | 产生蓝色沉淀,且沉淀逐渐增多,振荡后沉淀不消失,很快沉淀逐渐变黑色 |
| 实验序号 | 实验方法与操作 | 实验现象 | 结论 |
| ③ | 将少许Cu(OH)2粉末加到5mL蒸馏水中,充分振荡 | 沉淀不消失 | 猜想一错误 |
| ④ | 将少许Cu(OH)2粉末加到NaOH浓溶液中,充分振荡 | 沉淀消失,溶液变成亮蓝色 | 猜想二正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com