(2013?如皋市模拟)根据下列装置图,回答有关问题:
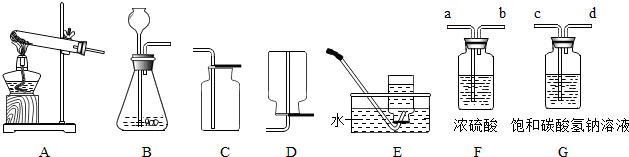
(1)①实验室用上图中A、C组合制取氧气,若选用KMnO
4,则反应的化学方程式是
,试管口要塞
棉花
棉花
,验满方法是
将带火星的木条靠近集气瓶口,若木条复燃,证明已收集满氧气
将带火星的木条靠近集气瓶口,若木条复燃,证明已收集满氧气
.
②如果做铁丝在氧气中燃烧的实验,最好用
E
E
装置收集氧气.
(2)实验室通常利用上图中
BC
BC
装置的组合制取二氧化碳(选填字母),该反应的化学方程式为
CaCO3+2HCl═CaCl2+CO2↑+H2O
CaCO3+2HCl═CaCl2+CO2↑+H2O
.
①将制得的二氧化碳气体通入紫色石蕊溶液,你将观察到的现象是
紫色石蕊溶液变红
紫色石蕊溶液变红
,将变色后溶液加热至沸腾一段时间,发现液体始终未变色,可能的原因是
使用较浓盐酸,在制得的二氧化碳气体中混入了氯化氢气体
使用较浓盐酸,在制得的二氧化碳气体中混入了氯化氢气体
.为了得到纯净、干燥的二氧化碳气体,除杂装置(如右图)的导管按气流方向连接顺序是
C
C
(选填字母).
A.a→b→c→d B.b→a→c→d C.c→d→a→b D.d→c→b→a
②检验二氧化碳的存在,可以将上图F装置中的浓硫酸换成
澄清石灰水
澄清石灰水
,该反应的化学方程式为
CO2+Ca(OH)2═CaCO3↓+H2O
CO2+Ca(OH)2═CaCO3↓+H2O
.





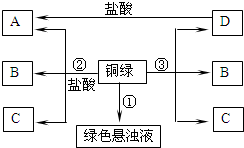 (2013?如皋市模拟)小彤的一副眼镜戴了一段时间后,发现铜质镜架上出现了一层绿色物质,他想将其除掉.经查阅资料得知:铜在一定条件下会锈蚀生成一种绿色物质,其主要成分是碱式碳酸铜[俗称铜绿,化学式为Cu2(OH)2CO3],该物质受热不稳定易分解.他根据元素守恒分析,得出铜生锈是铜与空气中的氧气、二氧化碳和
(2013?如皋市模拟)小彤的一副眼镜戴了一段时间后,发现铜质镜架上出现了一层绿色物质,他想将其除掉.经查阅资料得知:铜在一定条件下会锈蚀生成一种绿色物质,其主要成分是碱式碳酸铜[俗称铜绿,化学式为Cu2(OH)2CO3],该物质受热不稳定易分解.他根据元素守恒分析,得出铜生锈是铜与空气中的氧气、二氧化碳和