
| A. | 由C、H、N、P、O五种元素组成 | B. | 碳、氧元素的质量比是2:1 | ||
| C. | 它在空气中燃烧属于氧化反应 | D. | 它是一种有机物 |
分析 A、根据酒精化学式的含义进行分析解答.
B、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
C、根据氧化反应的概念进行分析.
D、根据有机物的概念进行分析.
解答 解:A、根据药物的主要成分是一种化学式C16H31N2PO8可判断该物质由C、H、N、P、O五种元素组成;故A说法正确;
B、根据药物的主要成分是一种化学式C16H31N2PO8可计算C、O元素的质量比=(12×16):(16×8)=3:2;故说法不正确;
C、它在空气中燃烧是该物质与氧气的反应,属于氧化反应,故C说法正确;
D、根据药物的主要成分是一种化学式C16H31N2PO8可知,该物质是含有碳元素的化合物,属于有机物;故D说法正确.
故选B.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 水通电分解生成氢气和氧气,说明水是由氧气和氢气组成的 | |
| B. | 将燃着的木条伸入某瓶气体中,木条熄灭,则该气体一定是二氧化碳 | |
| C. | 白磷可以在氧气中燃烧,说明氧气具有可燃性 | |
| D. | 将紫色石蕊试液分别滴入稀盐酸、稀硫酸中,紫色石蕊均变红,说明酸一般能使紫色石蕊变红 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 组别 | 药 品 | 实 验 结 果 |
| ① | 块状石灰石和稀盐酸 | 产生气泡,速率适中 |
| ② | 块状石灰石和稀硫酸 | 产生气泡,速率缓慢并逐渐停止 |
| ③ | 碳酸钠粉末与稀盐酸 | 产生气泡,速率很快 |
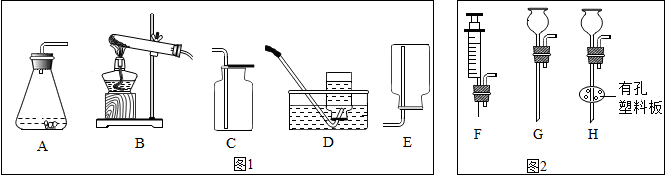
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 大量使用化肥和农药,以提高农作物产量 | |
| B. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 | |
| C. | “天宫一号”中使用的碳纤维,是一种新型有机高分子材料 | |
| D. | 为改善食品的色、香、味并防止变质,可加入大量食品添加剂 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
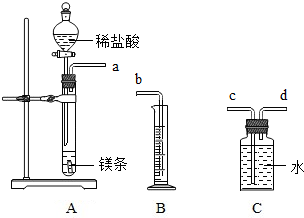 请利用如图给定的仪器组装成一套测定镁的相对原子质量的实验装置(每种仪器只允许使用一次),用排水法测量化学反应产生氢气的体积,根据化学方程式计算出镁的相对原子质量,回答问题:
请利用如图给定的仪器组装成一套测定镁的相对原子质量的实验装置(每种仪器只允许使用一次),用排水法测量化学反应产生氢气的体积,根据化学方程式计算出镁的相对原子质量,回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com