
分析 (1)可以根据净化水的方法方面进行分析、判断,从而得出正确的结论,过滤能除去水中的不溶性固体杂质,活性炭具有吸附性,能吸附色素和异味;
(2)根据化合价规则可以求出化合物中某元素的化合价;
(3)在含有CaCl2、MgCl2的水中可加入过量Ca(OH)2、Na2CO3的将水的Ca2+、Mg2+转变成CaCO3、Mg(OH)2沉淀,要注意过量的Ca(OH)2、Na2CO3的除去问题,如先加碳酸钠,再加氢氧化钙,最后用盐酸调节水的酸碱度时,又会生成氯化钙,无法除去硬水中较多的可溶性钙的化合物.
解答 解:(1)过滤可以除去固体小颗粒.故填:过滤.活性炭具有吸附性,能吸附色素和异味.故填:吸附.
(2)次氯酸中氢元素的化合价是+1价,氧元素是-2价,设氯元素的化合价为x,
则(+1)+x+(-2)=0,
x=+1
用氯气消毒过的自来水中含有盐酸,并且盐酸可与烧碱、纯碱发生反应而减少溶液中这两种物质的质量,因此用这种水在进行盐酸、烧碱溶液、纯碱溶液配制时因溶质质量的变化而影响所配制溶液的质量分数;
故选②④;
(3)除去水中的CaCl2、MgCl2时,如先加碳酸钠,再加氢氧化钙,最后水中含有过量的氢氧化钙,用盐酸调节水的酸碱度时,又会生成氯化钙,无法除去硬水中较多的可溶性钙的化合物,所以应先加Ca(OH)2,然后加Na2CO3,一方面除去氯化钙,又除去过量的氢氧化钙,最后再用盐酸除去过量的Na2CO3、NaOH,涉及到的方程式有:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2、CaCl2+Na2CO3=2NaCl+CaCO3↓、Na2CO3+Ca(OH)2=2NaOH+CaCO3↓、2HCl+Na2CO3=2NaCl+CO2↑+H2O、HCl+NaOH=NaCl+H2O.
答案:
(1)过滤;吸附;
(2)+1;②④;
(3)Ca(OH)2;Na2CO3;MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2;Na2CO3、NaOH.
点评 解答本题要掌握溶液的知识、化合价的知识、净化水的知识,只有这样才能对问题做出正确的判断.


科目:初中化学 来源: 题型:选择题
| A. | 镁带在空气中燃烧后,生成的氧化镁的质量比镁重 | |
| B. | 煤燃烧后留下的煤灰比煤轻 | |
| C. | 16克硫在氧气中燃烧生成32克二氧化硫 | |
| D. | 水加热沸腾一段时间后质量变轻 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
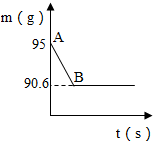 鸡蛋壳的主要成分是碳酸钙.某兴趣小组为了测定鸡蛋壳中CaCO3的含量,现取15g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入80g某浓度的稀盐酸,使之充分反应(鸡蛋壳中除CaCO3外的其他成分都不溶于水,且不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发),其中当反应进行到B点时,所有盐酸刚好消耗了加入量的一半.试计算(计算结果保留1位小数):
鸡蛋壳的主要成分是碳酸钙.某兴趣小组为了测定鸡蛋壳中CaCO3的含量,现取15g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入80g某浓度的稀盐酸,使之充分反应(鸡蛋壳中除CaCO3外的其他成分都不溶于水,且不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发),其中当反应进行到B点时,所有盐酸刚好消耗了加入量的一半.试计算(计算结果保留1位小数):查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 增大 | B. | 减小 | C. | 不变 | D. | 等于 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
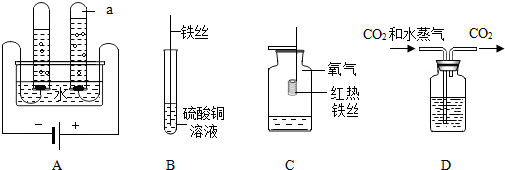
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 4 | 10 | 1 | 25 |
| 反应后质量/g | 未测 | 21 | 10 | 9 |
| A. | X可能是该反应的催化剂 | |
| B. | 若X与Q相对分子质量之比为1:2,则其化学计量数之比也为1:2 | |
| C. | 该反应为分解反应 | |
| D. | 该反应为氧化反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 使用弹簧测力计时,应先调零,后进行测量 | |
| B. | 稀释浓硫酸时先将浓硫酸倒入烧杯中,后将水沿着烧杯壁慢慢倒入浓硫酸中 | |
| C. | 使用显微镜观察细胞时,先调节细准焦螺旋,后调节粗准焦螺旋 | |
| D. | 实验室制取氧气,停止加热时,应先熄灭酒精灯,再把导管移出水面 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
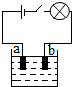 小李同学查阅资料了解到化合物根据导电性的不同,可分为电解质和非电解质两大类.其中在水溶液里或熔化状态下能够导电的化合物叫做电解质,在水溶液里或熔化状态下都不能导电的化合物叫做非电解质.于是他以食盐、硝酸钾、蔗糖、氢氧化钠和硫酸铜为材料,按下图所示的装置进行实验,实验结果记录如下表:
小李同学查阅资料了解到化合物根据导电性的不同,可分为电解质和非电解质两大类.其中在水溶液里或熔化状态下能够导电的化合物叫做电解质,在水溶液里或熔化状态下都不能导电的化合物叫做非电解质.于是他以食盐、硝酸钾、蔗糖、氢氧化钠和硫酸铜为材料,按下图所示的装置进行实验,实验结果记录如下表:| 物质 导电性 状态 | 食盐NaCl | 硝酸钾KNO3 | 蔗糖C12H22O18 | 氢氧化钠NaOH | 硫酸铜CuSO4 |
| 固态 | × | × | × | × | × |
| 熔化状态 | √ | √ | × | √ | √ |
| 水溶液 | √ | √ | × | √ | √ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | M | N | P | Q |
| 反应前质量/g | 6.2 | 1.0 | 65.0 | 0 |
| 反应后质量/g | 0 | X | 68.1 | 3.1 |
| A. | N物质可能为该反应的催化剂 | |
| B. | 该反应为分解反应 | |
| C. | 该反应中,M、Q两种物质变化的质量比为 2:1 | |
| D. | P可能是反应物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com