
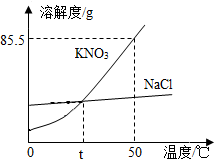
 如图为KNO3、NaCl的溶解度曲线.
如图为KNO3、NaCl的溶解度曲线.分析 根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:(1)通过分析溶解度曲线可知,硝酸钾的溶解度受温度影响较大;
(2)氯化钠的溶解度受温度的影响较小,所以除去NaCl中混有的少量KNO3的方法是加水充分溶解,蒸发结晶,然后过滤、洗涤、干燥;
(3)50℃时,硝酸钾的溶解度是85.5g,所以向100g水中加入60g KNO3,溶液质量为160g,若要增大溶质的质量分数,可以增加溶质,蒸发溶剂,降低温度,故选:①③⑤;
(4)50℃时,硝酸钾的溶解度大于氯化钠的溶解度,t℃时,氯化钠和硝酸钾的溶解度相等,所以温度为50℃且等质量的NaCl和KNO3的饱和溶液,将两溶液分别降温至t℃时,析出固体的质量:NaCl<KNO3,溶液中溶剂的质量:NaCl>KNO3,溶液中溶质的质量:NaCl=KNO3,故选:AC.
故答案为:(1)硝酸钾的溶解度受温度影响较大;
(2)蒸发结晶;
(3)①③⑤;
(4)AC.
点评 本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.


科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氨气液化是物理变化 | B. | 液氨具有可燃性,可用作燃料 | ||
| C. | X的化学式为N2 | D. | 该反应属于复分解反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 盛放石灰水的试剂内壁上出现一层白色固体 | |
| B. | 敞口放置的氯化钠饱和溶液中有白色固体析出 | |
| C. | 浓硫酸溅到白纸上,白纸变黑 | |
| D. | 建筑工地上生石灰长时间露天放置 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com