
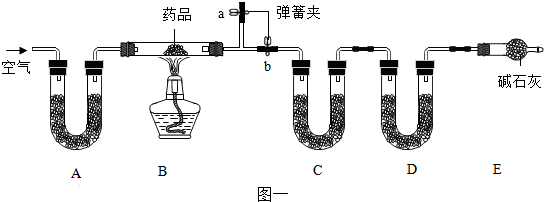

分析 实验一、(1)分析本题的实验装置可知,样品铝碳酸镁片在加热条件下分解生成铝和镁的氧化物、CO2、H2O,装置C中应放入能吸水的物质,但不能吸收二氧化碳气体,否则无法确定生成的水和二氧化碳各自的质量;
(2)实验开始前先通入一段时间空气,气目的是赶净装置B中的二氧化碳和水蒸气,确保CD两装置吸收的水蒸气、二氧化碳全部是样品分解生成的;
(3)一段时间后,打开弹簧夹,继续通入空气至玻璃管冷却的目的是 使生成的水和二氧化碳进入C、D被充分吸收
实验二、
(1)由图象分析,NaOH加入0.80g,仍没有沉淀,说明滤液含硫酸,当加入NaOH的质量到x时,生成的沉淀有氢氧化镁和氢氧化铝;图象分析沉淀3.48g为Mg(OH)2,Al(OH)3的质量量为5.04-3.48g=1.56g;据此计算x的数值;
(2)依据胃酸主要成分是盐酸,和该药反应生成的二氧化碳容易使胃壁穿孔;
(3)根据以上数据推算样品的化学式.
解答 解:
实验一、
(1)分析本题的实验装置可知,样品铝碳酸镁片在加热条件下分解生成铝和镁的氧化物、CO2、H2O,装置C中应放入能吸水的物质,但不能吸收二氧化碳气体,否则无法确定生成的水和二氧化碳各自的质量,所以装置C中是吸收水蒸气,利用无水CaCl2或P2O5 可以吸收,装置D是吸收二氧化碳气体的装置,可以利用碱石灰吸收二氧化碳气体,故为:CaCl2; 碱石灰;
(2)实验开始前先通入一段时间空气,气目的是赶净装置B中的二氧化碳和水蒸气,确保CD两装置吸收的水蒸气、二氧化碳全部是样品分解生成的;
(3)所以通入的空气必须先除去空气中的水和二氧化碳A装置中应放入碱石灰或固体氢氧化钠,实验开始前先通入一段时间空气,其目的是排除装置B中的CO2、H2O,其操作方法是;关闭弹簧夹b,打开弹簧夹a;当B处的酒精灯点燃后以及反应结束后一段时间内仍然要通入空气的目的是排出固体分解产生的CO2、H2O,使其被充分吸收,其操作方法是;关闭弹簧夹b,打开弹簧夹a;
实验二、
(1)由图象分析,NaOH加入0.80g,仍没有沉淀,说明滤液含硫酸,当加入NaOH的质量到x时,生成的沉淀有氢氧化镁和氢氧化铝;图象分析沉淀3.48g为Mg(OH)2,Al(OH)3的质量量为5.04-3.48g=1.56g;
设与硫酸镁反应的氢氧化钠的质量为x,与硫酸铝反应的氢氧化钠的质量为y,x
MgSO4+2NaOH═Mg(OH)2↓+Na2SO4 Al2(SO4)3+6NaOH═2Al(OH)3↓+3Na2SO4
80 58 240 156
x 3.48g y 1.56g
$\frac{80}{x}=\frac{58}{3.48g}$ $\frac{240}{y}=\frac{156}{1.56g}$
x=4.8g y=2.4g
则x=4.8g+2.4g+0.8g=8g;
(2)胃酸主要成分是盐酸,和该药反应生成的二氧化碳容易使胃壁穿孔,故答案为:因为胃酸和该药作用产生CO2会刺激胃粘膜,导致胃穿孔;
(3)根据质量守恒定律,反应前后元素的质量不变,根据以上数据,3.48gMg(OH)2中镁元素的质量为1.44g,原子个数为6个,Al(OH)3的质量量1.56g,铝元素的质量为0.54g,原子个数为2个,
故铝碳酸镁的化学式为Al2Mg6(OH)16CO3•4H2O
答案:实验一、
(1)③②;
(2)b; a; 排尽空气防干扰;
(3)b;a;③;
实验二、
(1)H2SO4 ;Mg(OH)2;Al(OH)3;1.56;8;
(2)与胃中盐酸反应产生CO2,加重病情或造成胃穿孔、胃出血
(3)Al2Mg6(OH)16CO3•4H2O;
点评 根据装置图中各装置的作用,推断实验过程中该装置的操作方法,参与到实验的探究活动中,此为解答类似探究问题的方法.本题考查了物质性质的探究实验方法,实验方案设计和物质组成的计算分析,图象分析计算的应用,掌握分析方法,物质性质是解题关键,题目难度较大.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
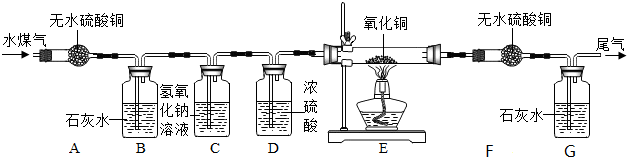
| 称量项目 | 反应前 | 反应后 |
| F玻璃管及所盛固体的质量 | 86.3g | 89.9g |
| G洗气瓶和所盛石灰水的质量 | 284.2g | 293.0g |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
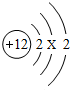 将宏观、微观及化学符号联系在一起是化学学科的特点.
将宏观、微观及化学符号联系在一起是化学学科的特点.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  用KClO3和MnO2制取氧气 | |
| B. |  向盐酸中加水 | |
| C. |  向CuSO4和稀硫酸混合溶液中加入NaOH溶液 | |
| D. |  加热蒸发稀盐酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | +3 | B. | +4 | C. | +5 | D. | +6 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
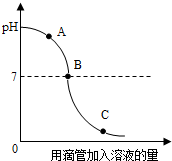 实验小组探究盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如图所示曲线.根据如图回答下列问题:
实验小组探究盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如图所示曲线.根据如图回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com