
| 实验一 | 实验二 | 实验三 | 实验四 | |
| 原固体混合物的质量 | 10g | 10g | 10g | 10g |
| 加入稀硫酸的质量 | 20g | 40g | 80g | 85g |
| 生成气体的质量 | 0.1g | m | 0.4g | 0.4g |
分析 根据第3次加入稀硫酸时,仍然能够产生氢气,说明第2次加入稀硫酸时,硫酸完全反应,生成的氢气应该是第1次生成氢气的质量2倍;也就是说每20g稀硫酸可以生成0.1g氢气,那么80g稀硫酸可以生成0.4g氢气,实验四算的质量增加,生成氢气的质量不变,说明实验三恰好完全反应.
根据氢气的质量求出混合物中镁的质量、稀硫酸中溶质质量以及硫酸镁的质量,进根据生成的硫酸镁以及原混合物中硫酸镁的质量,利用溶质质量分数公式求出反应后溶液中硫酸镁的质量分数即可.根据生成的硫酸镁以及原混合物中硫酸镁的质量,利用溶质质量分数公式求出反应后溶液中硫酸镁的质量分数即可.
解答 解:根据第3次加入稀硫酸时,仍然能够产生氢气,说明第2次加入稀硫酸时,硫酸完全反应,生成的氢气应该是第1次生成氢气的质量2倍;也就是说每20g稀硫酸可以生成0.1g氢气,那么80g稀硫酸可以生成0.4g氢气,实验四算的质量增加,生成氢气的质量不变,说明实验三恰好完全反应.
设设混合物中镁的质量为x,稀硫酸中溶质质量为y,生成硫酸镁的质量为z.
Mg+H2SO4═MgSO4+H2↑
24 98 120 2
x y z 0.4g
$\frac{24}{x}=\frac{98}{y}=\frac{120}{z}=\frac{2}{0.4g}$
x=4.8g
y=19.6g
z=24g
(1)实验中所用稀硫酸的溶质质量分数=$\frac{19.6g}{80g}×$100%=24.5%;
(2)则原混合物中硫酸镁的质量为:10g-4.8g=5.2g
实验所得溶液中硫酸镁的质量为24g+5.2g=29.2g
实验所得溶液质量=10g+110.4g+80g-0.4g=200g
恰好完成反应那次实验所得溶液中溶质的质量分数=$\frac{29.2g}{200g}×$100%=14.6%
答案:
(1)实验中所用稀硫酸的溶质质量分数为24.5%;
(2)恰好完成反应那次实验所得溶液中溶质的质量分数为14.6%.
点评 本题主要考查有关化学方程式的计算以及溶质的质量分数的计算,难度较大,需要注意规范的解题步骤.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:初中化学 来源: 题型:选择题
| A. | 空气中主要成分是氮气和氧气 | |
| B. | 空气中氧气主要来自植物的光合作用 | |
| C. | 空气中PM2.5含量高说明空气质量好 | |
| D. | 空气中的氮气可作焊接金属的保护气 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 磷在空气中燃烧,产生大量白雾 | |
| B. | 铜丝在空气中灼烧后变成黑色固体 | |
| C. | 木炭燃烧后生成无色无味气体 | |
| D. | 镁带在空气中燃烧,发出耀眼的白光,生成白色固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
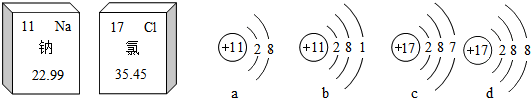
| A. | 钠、氯都属于金属元素 | B. | a表示的是一种阴离子 | ||
| C. | 氯的相对原子质量是35.45g | D. | 氯化钠是由a、d两种粒子构成的 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.
某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.| 实验操作 | 实验现象及结论 |
| 取少量黄色固体于试管中,加入适量的水,并将湿润的红色石蕊试纸放在试管口 | 试管中有气体产生,湿润的红色石蕊试纸变蓝.证明猜想正确. |
| 实验序号 | 实验1 | 实验2 | 实验3 | |
| 与镁条反应的溶液 | NH4Cl | NaCl | Na2SO4 | H2O |
| 实验现象 | 有大量气泡产生 | 有较多气泡产生 | 有少量气泡产生 | 气泡较少 |
| 加热后,实验现象 | 气泡明显增多可闻到氮味 | 气泡增多 | 气泡增多 | 气泡增多 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 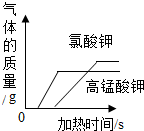 分别加热等质量的氯酸钾与高锰酸钾制氧气 | |
| B. | 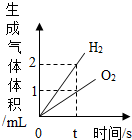 水的电解 | |
| C. | 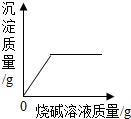 向含有硫酸的硫酸铜溶液中滴加烧碱溶液 | |
| D. | 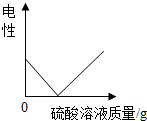 向氢氧化钡溶液中,逐滴加入硫酸溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选 项 | 归 类 | 物 质 |
| A | 有机物 | 淀粉、油脂、酒精 |
| B | 挥发性酸 | 浓盐酸、浓硫酸、浓硝酸 |
| C | 可燃性气体 | 氢气、氧气、一氧化碳 |
| D | 形成酸雨的气体 | 二氧化硫、氮氧化物、二氧化碳 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com