
| ||
| ||
| 36.5 |
| 73g×20% |
| 40 |
| x |
| 16g |
| 160g |


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:初中化学 来源: 题型:
| A、稀有气体在通常条件下几乎不与任何物质发生反应,化学性质比较稳定 |
| B、铁制品锈蚀主要是铁与空气中氧气、水蒸气发生化学反应的结果 |
| C、溶液具有均一性和稳定性,是因为溶液中的各种粒子都静止不动 |
| D、元素周期表是学习和研究化学、探索未知世界的重要工具 |
查看答案和解析>>
科目:初中化学 来源: 题型:
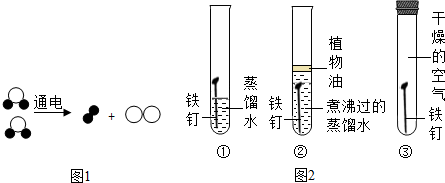
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
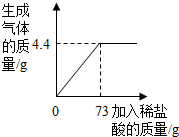 某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图.
某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图.查看答案和解析>>
科目:初中化学 来源: 题型:
| A、铁和硝酸铜溶液 |
| B、铁片和稀硫酸 |
| C、氢氧化钡溶液和稀硫酸 |
| D、氯化钠溶液和硝酸银溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com