
【题目】(18分)硫酸亚铁铵晶体俗名为摩尔盐,化学式为xFeSO4·y(NH4)2SO4·zH2O,在制药、电镀方面有广泛的应用。
资料: ①硫酸亚铁铵晶体易溶于水,不溶于乙醇;
②相关物质的溶解度(单位:g)如下表:
温度/℃ | FeSO4 | (NH4) 2SO4 | xFeSO4·y(NH4)2SO4·zH2O |
10 | 20.0 | 73 | 17.2 |
20 | 26.5 | 75.4 | 21. 6 |
30 | 32.9 | 78 | 28.1 |
③硫酸亚铁铵晶体受热时,在200℃以下只有结晶水失去。
【探究一】:制备硫酸亚铁铵晶体
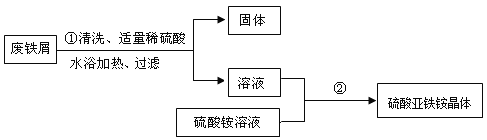
某兴趣小组的学生用含有少量铜的废铁屑制备硫酸亚铁铵晶体,流程如下:
(1)在盛有废铁屑的容器中,倒入热水和洗涤剂,充分搅拌。以除去废铁屑表面的油污,这是利用洗涤剂的 作用;
(2)操作①中发生反应的化学方程式为 ;
(3)过滤所需的玻璃仪器有烧杯、玻璃棒、 。过滤操作中滤纸有多种折法,为了加快过滤速率,你选择折法是 ;
(4)操作①中过滤时,要趁热进行的原因是 ,过滤后得到的固体中一定含有的物质是 ;
(5)操作②的目的是得到硫酸亚铁铵晶体。操作顺序是b→ → →d;
a.过滤 b.加热浓缩 c.冷却结晶 d.洗涤干燥
(6)操作②中使用乙醇洗涤,可快速晾干。这样做的优点是 ;
A、避免用水洗涤所造成的晶体损耗
B、酒精易挥发,可低温晾干晶体
【探究二】:探究硫酸亚铁铵的组成
【实验步骤】:取2份等质量的硫酸亚铁铵晶体,分别进行实验。向一份中加入过量的NaOH溶液,充分反应后得到0.68gNH3;向另一份中加入过量的BaCl2溶液,充分反应后过滤、洗涤、干燥得到9.32g沉淀。
回答下列问题:
(7)实验中生成的NH3能使湿润的 变蓝;写出(NH4)2SO4与NaOH反应的化学方程式 ,属于 反应;
(8)实验中加入过量BaCl2溶液的目的 ;
(9)取最后一次洗涤液,加入Na2SO4溶液, ,则说明沉淀已经洗涤干净;
(10)根据实验数据,计算x 和y的比值(2分,写出计算过程;相对分子质量:NH3-17、BaSO4-233)
;
为进一步确定硫酸亚铁铵晶体的组成,另取7.84g硫酸亚铁铵晶体,并加热使其分解,剩余固体质量与温度的关系如图所示。则:
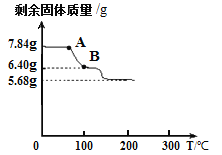
(11)根据图示数据,硫酸亚铁铵晶体中,
x:y:z = ;
(12)写出A点到B点发生反应的化学方
程式 /span>。
【答案】(1)乳化
(2)Fe + H2SO4==FeSO4 + H2↑
(3)漏斗 C
(4)防止FeSO4晶体析出 Cu
(5)c a
![]() (6)AB(漏选不给分)
(6)AB(漏选不给分)
(7)红色石蕊试纸 (NH4)2SO4 + 2NaOH == 2NH3 ↑+ Na2SO4 + 2H2O 复分解
(8)使硫酸根完全沉淀(合理均给分)
(9)无沉淀
(10) xFeSO4·y(NH4)2SO4~ 2yNH3 ~ (x+y)BaSO4……………………(1分)
34y 233(x+y)
0.68g 9.32g
![]()
x:y=1:1……………………………………..(1分)
(11)1:1:6
(12)FeSO4·(NH4)2SO4·6H2O △ FeSO4·(NH4)2SO4·2H2O + 4H2O
【解析】
试题分析:(1)洗涤剂除去油污是因为它含表面活性剂,表面活性剂要使油以极小的液滴均匀悬浮在水中形成乳浊液的现象。其中的乳化剂所起的作用就叫乳化作用。
(2)操作①向铁屑中加硫酸,二者反应的化学方程式为Fe + H2SO4==FeSO4 + H2↑;
(3)过滤所需的玻璃仪器有烧杯、玻璃棒和漏斗。为了加快过滤速率,需要滤纸折叠后的表面积最大,所以应选择的折法是A;
(4)操作①中过滤时,如温度太低,硫酸亚铁的溶解度较低,其晶体会析出。所以要趁热进行。废铁屑中含一定量的铜,铜的活动性较弱不和稀硫酸反应,所以过滤后得到的固体中一定含有的物质是铜。
(5)硫酸亚铁铵晶体的溶解度较小,可通过加热浓缩而溶液浓度变大,促使形成硫酸亚铁铵的饱和溶液;然后再通过冷却结晶,使其从溶液中析出;再通过过滤分离出析出的晶体;最后洗涤干燥得到晶体。所以操作顺序是b→ c→ a →d;
(6)根据题意可知:硫酸亚铁铵晶体易溶于水,不溶于乙醇。所以操作②中使用乙醇洗涤,避免了用水洗涤所造成的晶体因溶解而损耗;且酒精易挥发,可低温晾干晶体。
【探究二】:(7)实验中生成的NH3极易溶于水,且能和水反应生成氨水,其溶液呈碱性,故能使湿润的 红色的石蕊试液变蓝;写出(NH4)2SO4与NaOH反应的化学方程式(NH4)2SO4 + 2NaOH == 2NH3 ↑+ Na2SO4 + 2H2O,此反应中(NH4)2SO4与NaOH两种反应物相互交换了成分,生成硫酸钠和氨水,氨水不稳定增长而分解为氨气和水。从类型上来说属于复分解反应;
(8)为使硫酸根完全沉淀,在实验中加入过量BaCl2溶液;
(9)洗涤沉淀是为了除去沉淀上带有的溶液中的离子,如未洗涤干净,则加入Na2SO4溶液能与过量有剩余的氯化钡反应生成沉淀。所以当加入Na2SO4溶液无沉淀生成,说明沉淀已经洗涤干净;
(10)方法一:根据题意可知:已知量为生成氨气和硫酸钡沉淀的质量;未知量为晶体中x 和y的比值。解题思路:根据质量守恒定律可知,氮、硫两元素的质量在反应前后守恒。可根据生成氨气和硫酸钡沉淀的质量计算氮、硫元素的质量比;再根据晶体的化学式计算出氮、硫元素的质量比。二者相等,可计算出晶体中x 和y的比值。具体过程如下:
生成氨气0.68g,其中含氮元素的质量为:0.68g×(![]() ×100%)=0.56g。
×100%)=0.56g。
生成硫酸钡9.32g,其中含钡硫元素的质量为:9.32g×(![]() ×100%)=1.28g。
×100%)=1.28g。
根据质量守恒定律可知:氮、硫两元素在变化前后的质量相等。可列式为:
[14×2y]:[32×(x+y)] =0.56g:1.28g
则x:y=1:1
方法二:也可根据化学方程式计算此题。已知量为生成氨气和硫酸钡沉淀的质量;未知量为晶体中x 和y的比值。
xFeSO4·y(NH4)2SO4~ 2yNH3 ~ (x+y)BaSO4
34y 233(x+y)
0.68g 9.32g
34y:233(x+y)= 0.68g:9.32g
x:y=1:1
(11)根据“硫酸亚铁铵晶体受热时,在200℃以下只有结晶水失去”可知生成水的质量为7.84g—5.68g=2.16g。结合(10)中的数据及晶体的化学式[xFeSO4·y(NH4)2SO4·zH2O]可列式为:[14×2y]:[32×(x+y)]:36=0.56g:1.28g:: 2.16g 所以 x:y:z=1:1:6
(12)根据图像可知:A点到B点发生反应是失去了结晶水的质量为7.84g—6.40g=1.44g。结合(11)可知结晶水的总质量为2.16g。设A点到B点发生反应是失去了结晶水的数目为x,则可列式为:x:6=1.44g:2.16g,可解得x=4 所以反应的化学方程式为:FeSO4·(NH4)2SO4·6H2O△FeSO4·(NH4)2SO4·2H2O + 4H2O


科目:初中化学 来源: 题型:
【题目】(7分)在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液。该组同学对该实验进行了下列研究。
![]()
(1)溶液M的可能组成:
猜想①:是 ,
猜想②:是CaCl2(查资料知CaCl2水溶液呈中性)。
为了确定其组成,同学们设计了如下方案并进行实验:
实验操作 | 实验现象 | 实验结论 |
取少量M溶液于试管中,向其中滴加酚酞 | 猜想①正确 |
(2)若猜想①正确,则上述过滤后得到的澄清滤液中可能含有的溶质:
猜想一:NaOH和Na2CO3;
猜想二: ;
猜想三:NaOH。设计实验方案确定滤液中溶质的组成。
实验操作 | 实验现象 | 实验结论 |
分别取少量滤液于A、B两支试管中,A中加入CaCl2溶液,B中加入 溶液 | “猜想一”成立 | |
“猜想二”成立 | ||
“猜想三”成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:
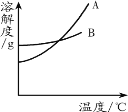
【题目】 下图是A、B、C三种物质的溶解度曲线。下列叙述错误的是
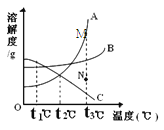
A.t1℃时,三种物质的溶解度大小顺序为A<B<C
B.将t3℃时,A、B、C的饱和溶液降温到t2℃所得溶液的溶质质量分数由大到小的顺序为B>A=C
C.当A中混有少量B时,可以用降温结晶的方法提纯A
D.若要将组成在N点的A溶液转变为M点的A溶液,
可以采取恒温蒸发溶剂的方法
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(6分)根据下面的溶解度表与溶解度曲线,回答下列问题:
温度/°C 溶解度/g | 0 | 20 | 40 | 60 | 80 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
(1)氯化钠溶液中的溶剂是 。
(2)20℃时,NaCl的溶解度是 g。
(3)图中能表示KNO3溶解度曲线的是 (填“A”或“B”)。
(4)20℃时,将40g KNO3放入盛有100g水的烧杯中,充分溶解,得到硝酸钾溶液的质量为 g,继续加热至80℃,下列各量一定变大的是 (填字母序号)。
A.溶质质量 B.溶剂质量 C.溶解度 D.溶质的质量分数
(5)实验室配制500g 10%氯化钠溶液需要氯化钠固体质量 g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(16分)化学用语是学习化学的重要工具。
(1)用化学符号表示:
①2个氧原子 ;②3个氮分子 ;③4个二氧化碳分子 ;
④氢氧根离子 ;⑤铝离子 ;⑥氧化铜中铜元素的化合价 。
(2)用字母序号填空:
A.硫酸铜 B.聚乙烯 C.干冰 D.氧化钙 E.氢气 F.碳酸钠
①可用于人工降雨的是 ; ②配制波尔多液的一种盐 ;
③侯德榜制得的碱 ; ④用作食品干燥剂的是 ;
⑤用于包装食品的是 ; ⑥绿色能源 。
(3)写出下列反应的化学方程式:
①红磷在空气中燃烧 ;
②电解水 ;
③实验室炼铁原理 ;
④过氧化钠(Na2O2)与CO2反应生成碳酸钠和氧气 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(5分)为了除去氯化钾固体样品中的少量氯化镁,一位同学设计了下图所示的除杂方案:

请回答:
(1)操作1的名称是 ,在操作中要用到的玻璃仪器中除烧杯、玻璃棒以外,还有 ;操作2的名称是 。
(2)甲溶液是 ,乙溶液是 。
A. 稀H2SO4 B. 稀HCl C. KOH D. NaOH
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为某化学反应的微观模拟图,其中“![]() ”表示氧原子,“
”表示氧原子,“![]() ”表示碳原子,“
”表示碳原子,“![]() ”表示氢原子.根据模拟图选择下列说法不正确的是:
”表示氢原子.根据模拟图选择下列说法不正确的是:
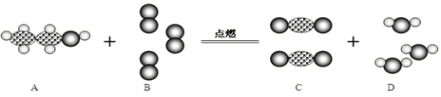
A.该反应属于氧化反应
B.在该反应中,两种反应物的分子个数比为1:3
C.A物质中碳、氢元素的质量比为12:1
D.C物质中碳元素的质量等于A物质中碳元素的质量
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列化学符号中数字表示的意义正确的是( )
A.CO2:“2”表示一个二氧化碳分子含有两个氧原子
B.2Na:“2”表示两个钠元素
C.![]() :“+2”表示镁离子带有两个单位正电荷
:“+2”表示镁离子带有两个单位正电荷
D.S2﹣:“2﹣”表示硫元素的化合价为负二价
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】 (6 分)某化学兴趣小组在实验室发现了
一瓶标签受到腐蚀(如图所示液,他们对此产生了兴趣。

[提出问题]这瓶溶液究竟是什么?
经过询问实验老师平时的药品保管得知,这瓶无色溶液应该是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中的某一种。为了确定该药品,他们首先进行了理论分析:
(1)小明根据标签上的组成元素认为一定不可能是______。
(2)小英提出,碳酸氢钠、硝酸钠也不可能,你认为她的依据是_______。
为了确定该溶液究竟是剩余两种盐的哪一种,他们设计了如下实验。
(3) 该瓶无色溶液是_______。生成白色沉淀过程的化学方程式是_______。
(4)小强认为上述设计实验还可简化,仍能达到目的。小强的实验操作是______。经查阅资料得知上述五种盐里碳酸钠、碳酸氢钠的溶液呈碱性,其余三种盐的溶液呈中性,请你再设计一种实验方法,确定该溶液究竟是哪种盐。简述实验操作和现象____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com