
 (1)某同学按如图装置对质量守恒定律进行实验探究,观察到反应后天平不平衡,该反应 质量守恒定律(填“符合”或“不符合”),理由是 .
(1)某同学按如图装置对质量守恒定律进行实验探究,观察到反应后天平不平衡,该反应 质量守恒定律(填“符合”或“不符合”),理由是 . 4NO+6R,其中R的化学式为 .
4NO+6R,其中R的化学式为 . 

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:阅读理解
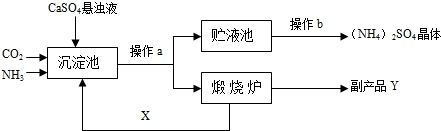
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 溶解度/g | 70.6 | 73 | 75.4 | 78 | 81 | 85 | 88 | ? | 95 | 98 | 103 |
| 指标项目 | 优等品 | 一等品 | 合格品 |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥20.7% | ≥20.5% |
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
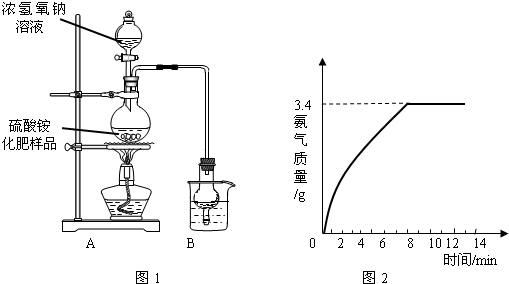
| 指标项目 | 优等品 | 一等品 | 合格品 |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥20.7% | ≥20.5% |
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
 某化学小组同学利用如图所示装置研究可燃物的燃烧条件.
某化学小组同学利用如图所示装置研究可燃物的燃烧条件.| 步骤 | 操作 | 现象 |
| ① | 点燃酒精灯加热 | 无现象 |
| ② | 盖灭酒精灯,待仪器恢复到常温 | 无现象 无现象 |
| ③ | 打开K,向球形管中通入氧气 打开K,向球形管中通入氧气 |
无现象 |
| ④ | 点燃酒精灯加热,继续通氧气 | 木炭燃烧,澄清石灰水变浑浊 木炭燃烧,澄清石灰水变浑浊 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 序号 | 实验内容 | 实验现象 | 实验结论 |
| ① | 取少量样品于烧杯中,滴加稀盐酸 | 有大量气泡生成 | 本格不填 |
| ② | 用铂丝蘸取①中溶液,在酒精灯上灼烧 | 火焰为砖红色 | 溶液中含有钙离子 |
| ③ | 另取少量样品于烧杯中,加水充分溶解,滴加 碘水或碘酒 碘水或碘酒 |
无蓝色出现 | 样品中不含有淀粉 |
| ④ | 另取少量样品于烧杯中,加水溶解,静置、过滤,在滤液中加入适量浓硝酸,加热至沸 | 产生黄色固体 产生黄色固体 |
样品中含蛋白粉 (氨基酸) |
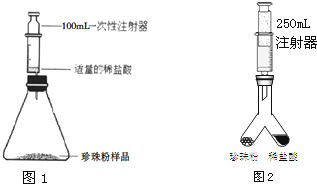
| 100 |
| x |
| 44 |
| 0.44g |
| 1g |
| 1.1g |
| 100 |
| x |
| 44 |
| 0.44g |
| 1g |
| 1.1g |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
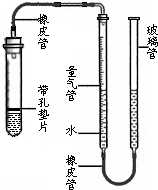 某课外活动小组同学用如图所示的装置(固定装置未画出)测定含有杂质的石灰石样品中碳酸钙的质量分数(杂质与酸接触不产生气体).实验过程是:
某课外活动小组同学用如图所示的装置(固定装置未画出)测定含有杂质的石灰石样品中碳酸钙的质量分数(杂质与酸接触不产生气体).实验过程是:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com