
【题目】现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:

(1)已知20℃,氧化钠溶解度为36g,则20时饱和食盐水溶质质量分数为______________;(保留1位小数)
(2)反应①的化学方程式是_______________________;
(3)甲溶液中能与石灰乳反应生成氨气的物质是_____________,实验室中通常检验氨气的试剂是______________;
(4)反应②的化学方程式是_____________________;
(5)整个生产过程中可循环利用的物质是_________________;
(6)为测定产品纯碱中钠元素质量分数,取样(样品中除纯碱外还含有碳酸氢钠和少量不溶性杂质)设计如下实验过程:
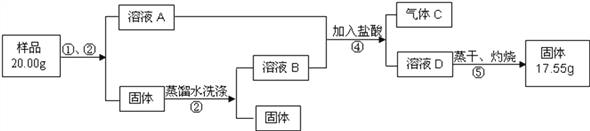
请回答:
Ⅰ.操作①是溶解,操作②为__________________;
Ⅱ.原样品中钠元素的质量分数为___________________;
Ⅲ.若测定结果偏低,原因可能是__________(填字母)。
A.溶液D中含有Na2CO3 B.溶液D中含有NaCl
C.操作③中固体没有洗涤干净 D.操作④中加入过量的盐酸
【答案】 26.5% CaCO3![]() CaO+CO2↑ NH4Cl 湿润的红色石蕊试纸 NaCl+CO2+ NH3+H2O=NaHCO3,↓+NH4Cl CO2和NH3 过滤 34.5% AC
CaO+CO2↑ NH4Cl 湿润的红色石蕊试纸 NaCl+CO2+ NH3+H2O=NaHCO3,↓+NH4Cl CO2和NH3 过滤 34.5% AC
【解析】(1)已知20℃,氧化钠溶解度为36g,则20时饱和食盐水溶质质量分数为: ![]() ;贝壳的主要成分是碳酸钙,碳酸钙在高温的条件下分解生成氧化钙和二氧化碳,化学方程式为:CaCO3
;贝壳的主要成分是碳酸钙,碳酸钙在高温的条件下分解生成氧化钙和二氧化碳,化学方程式为:CaCO3![]() CaO+CO2↑;(3)氯化铵和氢氧化钙反应生成氯化钙、氨气和水,氨气能使红色石蕊溶液变蓝,故实验室中通常检验氨气的试剂是湿润的红色石蕊试纸;(4)根据流程图可知,反应②是氯化钠、二氧化碳、水和氨气反应生成碳酸氢钠和氯化铵,化学方程式是:NaCl+CO2+ NH3+H2O=NaHCO3↓+NH4Cl;(5)通过分析反应原理可知,氨气、二氧化碳既是反应物,也是生成物,所以整个流程中可以循环利用的物质是CO2和NH3;(6) Ⅰ、操作①是溶解,操作是将不溶物和液体分离,故操作②为过滤;Ⅱ、根据质量守恒定律,纯碱样品中的钠元素等于氯化钠中钠元素的质量,故原样品中钠元素的质量分数为
CaO+CO2↑;(3)氯化铵和氢氧化钙反应生成氯化钙、氨气和水,氨气能使红色石蕊溶液变蓝,故实验室中通常检验氨气的试剂是湿润的红色石蕊试纸;(4)根据流程图可知,反应②是氯化钠、二氧化碳、水和氨气反应生成碳酸氢钠和氯化铵,化学方程式是:NaCl+CO2+ NH3+H2O=NaHCO3↓+NH4Cl;(5)通过分析反应原理可知,氨气、二氧化碳既是反应物,也是生成物,所以整个流程中可以循环利用的物质是CO2和NH3;(6) Ⅰ、操作①是溶解,操作是将不溶物和液体分离,故操作②为过滤;Ⅱ、根据质量守恒定律,纯碱样品中的钠元素等于氯化钠中钠元素的质量,故原样品中钠元素的质量分数为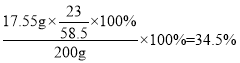 ;Ⅲ、若测定结果偏低,原因可能是:A、溶液D中含有Na2CO3 由于碳酸钠中钠元素的质量分数小于氯化钠中钠元素的质量分数,溶液中含有碳酸钠会使测定结果偏低,正确;B、溶液D中含有NaCl,测定结果不变,错误;C、操作③中固体没有洗涤干净,会使氯化钠中混有杂质,导致测量结果偏低,正确; D、操作④中加入过量的盐酸,盐酸在加热时挥发,对测量结果没有影响。
;Ⅲ、若测定结果偏低,原因可能是:A、溶液D中含有Na2CO3 由于碳酸钠中钠元素的质量分数小于氯化钠中钠元素的质量分数,溶液中含有碳酸钠会使测定结果偏低,正确;B、溶液D中含有NaCl,测定结果不变,错误;C、操作③中固体没有洗涤干净,会使氯化钠中混有杂质,导致测量结果偏低,正确; D、操作④中加入过量的盐酸,盐酸在加热时挥发,对测量结果没有影响。


科目:初中化学 来源: 题型:
【题目】海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景。工业上从海水中可提取许多广泛应用于生活、生产、科技等方面的物质和原料。
Ι.从海水中获得淡水
下列方法常用于海水淡化的是____________(填字母)。
A.蒸馏法 B.吸附法 C.沉淀法 D.过滤法
Ⅱ.从海水中提取溴(Br2)
工业上通常是将氯气通入海水晒盐后的母液中,将溶液中的溴化钠(NaBr)转化为溴单质(Br2),然后鼓入热空气,使溴单质(Br2)从溶液中挥发出来,冷凝后得到粗溴。该过程中主要反应的化学方程式为_______________________,其反应类型是______________。
Ⅲ.从海水中提取金属镁
镁及其合金是一种用途很广的金属材料,工业上从海水晒盐后的母液中提取镁的主要流程如下:
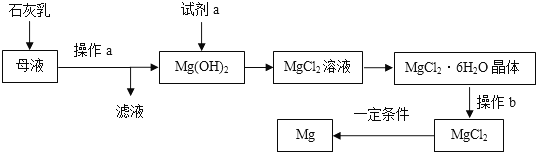
试回答下列问题:
(1)石灰乳主要成分的化学式为_____________。
(2)Mg(OH)2中加入试剂a发生反应的化学方程式为____________________________。
(3)操作b是在HCl气体氛围中高温灼烧进行的。若直接灼烧MgCl2·6H2O晶体,则生成MgO和另外两种化合物,写出有关反应的化学方程式___________________________ 。
Ⅳ.以海水中提取的食盐为原料制备纯碱
制备过程中主要涉及以下三步反应:
① CO2+NH3+H2O ══NH4HCO3
② NH4HCO3 + NaCl══NaHCO3 ↓ + NH4Cl
③ 2NaHCO3 ![]() Na2CO3+ CO2 ↑ + H2O
Na2CO3+ CO2 ↑ + H2O
试回答下列问题:
(1)制备过程中可以直接循环回收利用的物质是H2O和__________________。
(2)在实验室里证明反应③中的NaHCO3已完全分解的具体操作是________。
(3)某化学兴趣小组认为,在碳酸氢钠完全分解的情况下,所得的纯碱中也会混有来自反应②中的杂质,为此他们进行了如下探究:
a.取2.2g纯碱样品,加水完全溶解得100g溶液;
b.配制100g 3.65%的稀盐酸;
c.取上述一种溶液25g于锥形瓶中,再将另一种溶液逐滴加入锥形瓶内,反应后溶液的pH变化情况如下图所示。
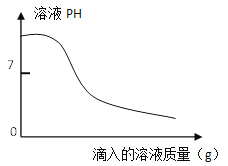
步骤c中当滴入另一种溶液为10g时,锥形瓶内物质恰好完全反应。则纯碱样品中碳酸钠的质量分数为___________(写出计算过程,计算结果保留1位小数)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了达到相应的实验目的,下列实验设计部不合理的是
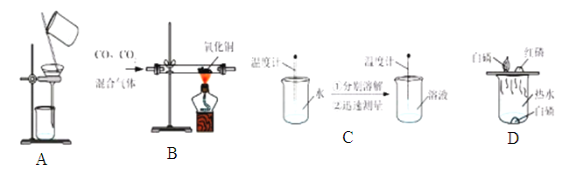
A.分离H2O2和MnO2制O2后的固液混合物 B.除去CO中的CO2气体
C.区分NaCl、NH4NO3、NaOH三种固体 D.探究可燃物燃烧的条件
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是A、B、C三种物质的溶解度曲线。下列说法错误的是

A.t2℃时,C物质的饱和溶液能用降温的方法转化为不饱和溶液
B.t1℃时,A、C物质饱和溶液中溶质的质量分数为25%
C.分别将t2℃时A、B、C三种物质的饱和溶液降温至t1℃,此时溶液中溶质的质量分数由大到小的顺序是B>A>C
D.当A中含有少量B时,可用降温结晶的方法提纯A
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A—F为初中化学学习中常见物质,且A、B、C、D中均含有同一种金属元素,物质间转化关系如图所示,下列说法不正确的是
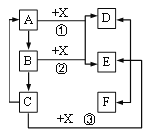
A. 物质X能用于金属除锈
B. 反应②是中和反应
C. 反应①②③都属于复分解反应
D. A、B、E、F一定是氧化物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】五氧化二钒(V2O5)是种工业催化剂,如图是制取的工艺流程。
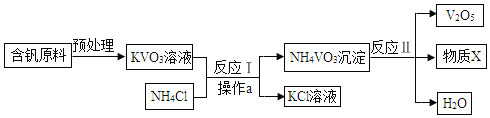
(1)写出反应Ⅰ的化学方程式为_____________________;操作a的名称是___________。
(2)反应Ⅱ的基本反应类型______________。
(3)物质X中一定含有的元素是__________(用元素符号表示)。
(4)写出副产物KCl的一种用途______________________(用10个左右的文字表示)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学们对制作糕点常用膨松剂Na2CO3或NaHCO3进行了下列探究。
【查阅资料】
溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
【探究一】NaHCO3和Na2CO3性质差异的探究
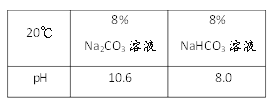
(1)现有20℃时溶质质量分数为8%的Na2CO3和NaHCO3溶液酸碱性:取样于试管中,分别滴加紫色石蕊试液,均显_____色;酸碱度:NaHCO3溶液________Na2CO3溶液(填“>”或”“<”)。
(2)稳定性:按下图,实验中可观察乙烧杯中的石灰水变浑浊,甲烧杯不变,则乙烧杯中发生反应的化学方程式为:___________________________。结论:在受热条件下,碳酸钠比碳酸氢钠稳定性______(填“强”或“弱”)。
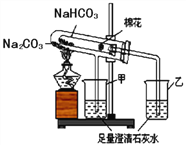
(3)利用溶解度鉴别NaHCO3和Na2CO3:分别取Xg两种固体粉末加入20℃,10g水中充分溶解,通过观察溶解现象来区分,X可以是下列的_______。(选填A、B或C)
A.1.5g B.0.96g C.0.5g
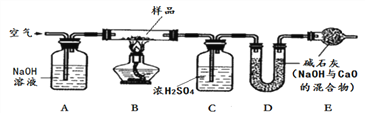
【探究二】测定NaHCO3和Na2CO3混合物10.0g中NaHCO3的质量分数(下图,夹持装置略)
【问题讨论】
(4)实验前先通一段时间的空气的目的是____________________;
(5)A的作用是_____________________________,若没有装置E,NaHCO3的质量分数测定结果会_____________(填“偏大”、“不变”或“偏小”)。
(6)停止加热后,仍继续通入空气一段时间,目的是___________________。
【含量测定】
(7)测得装置D的质量实验前为120.2g,实验后为122.4g,计算该样品中NaHCO3的质量分数。(要有计算过程)______________________
【知识拓展】
(8)向饱和的氯化钠溶液中通入氨气和二氧化碳,经过一系列变化,也可制得Na2CO3和一种铵盐。该反应的化学反应方程式为:_______________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有A、B、C、D、E五种溶液,它们分别是氢氧化钠溶液、硫酸铜溶液、碳酸钠溶液、氯化钠溶液和稀硫酸中的一种。鉴别它们可按下图所示的步骤进行,回答下列问题
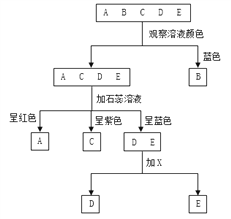
(1)溶液A、B、C中的溶质分别是A_________,B_________,C_________。(填化学式)
(2)用X鉴别D、E时,X可以选用不同的物质。
①若X为稀盐酸,写出有气体生成的反应的化学方程式____________________;
②若X为氯化钙溶液,写出有沉淀生成的反应的化学方程式____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据下列装置,回答问题:
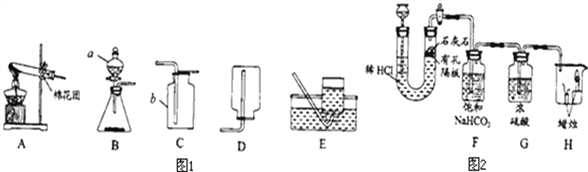
(1)写出图1中有标号仪器的名称: b______.
(2)①用高锰酸钾制取一瓶氧气,可选用装置A和______(选填序号)组合.装入药品前要先______;实验所用高锰酸钾工业上可用高纯度的二氧化锰为原料制取,主要流程如下:
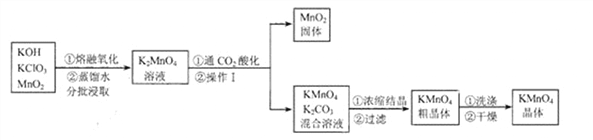
已知相关物质的溶解度(20℃)如下表:

②流程里K2MnO4中锰元素的化合价为__________。
③操作I的名称是_____。“干燥”过程中温度不宜过高的原因是_________________(用化学方程式表示)。
④“通CO2酸化”,反应的化学方程式为: 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3 若用稀H2SO4酸化,反应的化学方程式为: 3K2MnO4+2H2SO4=2KMnO4 +MnO2↓+2K2SO4+2H2O 工业上不采用稀H2SO4酸化的原因是____________________。
⑤电解法也可以实现由K2MnO4向KMnO4的转化,反应的化学方程式为:![]() 与“通CO2酸化”相比,其优点是___________。
与“通CO2酸化”相比,其优点是___________。
(3)用双氧水和二氧化锰制氧气,二氧化锰的作用是____,可选用的发生装置是____(填序号)。
(4)用如图2装置制取CO2并验证相关性质。
①生成CO2反应的化学方程式_________,该反应属_______反应(写基本反应类型);
②F装置的作用是______;
③H装置中的现象可说明CO2具有的性质是______(答一点即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com