

 CO↑+CO2↑+H2O;
CO↑+CO2↑+H2O; 2Fe+3CO2
2Fe+3CO2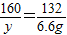
 :
: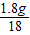 =1:2,所以x=2.
=1:2,所以x=2.

科目:初中化学 来源: 题型:
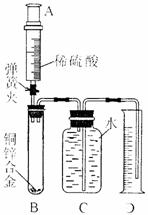
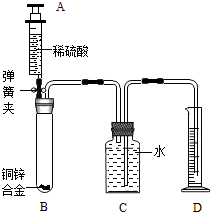 (2012?武汉)某化学小组利用下图所示装置测定铜锌合金样品中锌的质量分数(图中固定装置已略去)
(2012?武汉)某化学小组利用下图所示装置测定铜锌合金样品中锌的质量分数(图中固定装置已略去)查看答案和解析>>
科目:初中化学 来源: 题型:

| 浓硫酸 | 加热 |
查看答案和解析>>
科目:初中化学 来源:湖北省中考真题 题型:实验题

查看答案和解析>>
科目:初中化学 来源: 题型:
某化学小组利用下图所示装置测定铜锌合金样品中锌的质量分数(图中固定装置
已略去)
探究过程如下:
1.连接实验装置并检查装置气密性
Ⅱ.向B中加入质量为m的铜锌合金粉末,由注射器A向B
缓缓加入稀硫酸,待B中不再有气体产生气体时,夹紧弹簧夹,
立即移出D中导管,准确读取并记录量筒内水的体积。
Ⅲ.经过滤等操作,准确称量并记录B中剩余固体物质的
质量。
IV.该小组的甲同学根据反应前后B中固体物质的质量计
算样品中锌的质量分数;乙同学认定量筒内测得水的体积
即为反应生成气体的体积,并利用该气体在常温下的密度,根据化学方程式进行相关计算,得到样品中锌的质量分数。
请回答下列问题:
(1) B中发生反应的化学方程式是
。
(2)Ⅲ中,正确的操作顺序是:过滤、 、 、称量。
(3)通过误差分析,化学小组发现乙同学所用数据不可靠。造成该数据不可靠的原因及其对计算结果的影响是:
 ①II中,移出D中的导管内留存有水,导致计算结果偏小。
①II中,移出D中的导管内留存有水,导致计算结果偏小。
② ,导致计算结果偏 。
……
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
某化学小组利用下图所示装置测定铜锌合金样品中锌的质量分数(图中固定装置已略去)探究过程如下:
1.连接实验装置并检查装置气密性
Ⅱ.向B中加入质量为m的铜锌合金粉末,由注射器A向B缓缓加入稀硫酸,待B中不再有气体产生气体时,夹紧弹簧夹,立即移出D中导管,准确读取并记录量筒内水的体积。
Ⅲ.经过滤等操作,准确称量并记录B中剩余固体物质的质量。
IV.该小组的甲同学根据反应前后B中固体物质的质量计算样品中锌的质量分数;乙同学认定量筒内测得水的体积
即为反应生成气体的体积,并利用该气体在常温下的密度,根据化学方程式进行相关计算,得到样品中锌的质量分数。请回答下列问题:
(1)Ⅲ中,正确的操作顺序是:过滤、 、 、称量。
(2)通过误差分析,化学小组发现乙同学所用数据不可靠。造成该数据不可靠的原因及其对计算结果的影响是:
①II中,移出D中的导管内留存有水,导致计算结果偏小。
② 。
……
(3)日常生活中为方便使用通常将金属制成合金,伍角币为钢芯镀铜、一元币为钢芯镀镍(Ni)合金铸造以上硬币用到的材料都是 材料
‚选择铸造硬币的材料不需要考虑的因素是 (填序号)。
A. 金属的导电性 B. 金属的耐腐蚀性
C. 金属的硬度 D. 金属价格与硬币面值的吻合度
ƒ以上硬币涉及到Fe、Cu、Al、Ni(镍),已知Ni能够发生如下反应:
Ni+ H2SO4= Ni SO4+ H2↑ Fe+ Ni Cl 2= Ni + Fe Cl 2
四种金属活动性由强到弱的顺序为 (用元素符号表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com