





科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
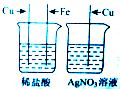
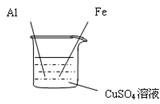
(12分)同学们已经学习了有关金属的一些知识,对金属的活动性顺序也有了一定的认识。请运用所学知识参与以下探究并回答相关问题:
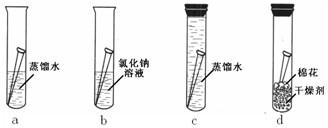
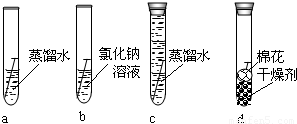
 【 实验一】将4枚洁净无锈的铁钉分别放入图12中 a、b、c、d 4支试管中。
【 实验一】将4枚洁净无锈的铁钉分别放入图12中 a、b、c、d 4支试管中。
|
上述实验中,____________试管中的铁钉最易生锈。设计如图d实验的目的是________
________________________________________。铁生锈的主要原因是铁与 、
等物质发生了复杂的化学反应。
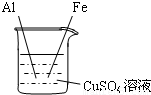
【 实验二】为了探究Fe、Cu、Al三种金属的活动性顺序,小宁同学做了图13所示的实验.
 (1)实验时,为了除去铝和铁表面的氧化物或污物,在插入溶液
(1)实验时,为了除去铝和铁表面的氧化物或污物,在插入溶液
前应将 。
(2)实验时观察到的主要现象是 ,
|
与硫酸铜溶液反应的化学方程式 。
(3)小成同学认为小宁同学设计的实验不能达到实验目的,原因是
,因此另设计一个实验,才能得出正确的结论。请你设计一个实验并完成下表:
| 操 作 | 现 象 | 结 论 |
|
|
| 三种金属活动性由强到弱的顺序是:Al 、Fe、Cu |
查看答案和解析>>
科目:初中化学 来源:0122 模拟题 题型:填空题
查看答案和解析>>
科目:初中化学 来源:2008-2009学年江西省南昌19中九年级(下)第三次月考化学试卷(解析版) 题型:解答题
| 操作 | 现象 | 结论 |
| ______ | ______ | 三种金属活动性由强到弱的顺序是:Al、Fe、Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com