
【题目】(1)用适当的数字和符号填空:①氧化镁中镁元素显+2价___________;②1个亚铁离子___________; ③氦气_________; ④形成化合物种类最多的元素________;
(2)现有六种物质,选择相应物质的字母填空:A金刚石 B汽油 C小苏打 D熟石灰 E蛋白质 F锰钢
①____可用于治疗胃酸过多症 ②____可用于制造钢轨
③____是构成细胞的基本物质 ④____可用来切割大理石
【答案】![]() Fe2+ He C C F E A
Fe2+ He C C F E A
【解析】
(1)①由元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,氧化镁中镁元素显+2价可表示为:![]() ;
;
②离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.表示多个离子在离子符号前面加数字,且亚铁离子带两个单位的负电荷,故1个亚铁离子符号为:Fe2+;
③氦气单原子分子,用元素符号直接代表化学式,氦气符号为:He;
④形成化合物种类最多的元素是C;
(2) ①小苏打溶于水显碱性,且能和胃酸反应,所以可用于治疗胃酸过多症,故填C;
②锰钢的硬度且耐腐蚀,所以可用于制造钢轨,故填F;
③蛋白质是构成细胞的基本物质,故填E;
④金刚石的硬度大,所以可用来切割大理石,故填A。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:初中化学 来源: 题型:
【题目】5分)镁是一种用途很广的金属,目前世界上60%的镁是从海水(主要含NaCl和MgCl2等)中提取的。主要步骤如下:
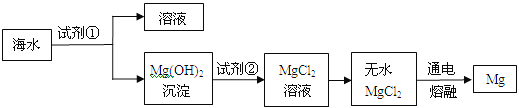
(1)上述步骤中试剂①应过量,理由是 。
(2)请写出Mg(OH)2沉淀与试剂②发生中和反应的化学方程式 。
(3)无水MgCl2在熔融状态下通电得到金属镁和物质A,氢气在物质A中燃烧生成物质B,则物质A和B的化学式分别为:A ,B 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl,其它成分不考虑。请回答下列问题:
(1)味精中至少含有__________(填数字)种元素。
(2)称取5.0g味精配制成50g溶液,量取蒸馏水的量筒规格是_________(填字母)。
A.5mL B. 10 mL C. 50 mL D. 100 mL
(3)下图是配制过程,正确的操作顺序为_______(填字母) 。
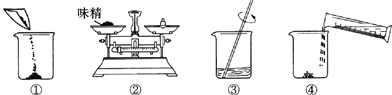
A.①②③④ B.②①④③ C.②④①③
(4)为测定NaCl在味精中的质量分数,进行如下实验:
①向所配制的50g溶液中加入AgNO3溶液充分反应,检验沉淀是否完全的方法是:静置后,在上层清液中加入______(填化学式)溶液,观察是否有沉淀生成。
②在其它操作均正确的情况下,若在配制溶液过程中,仰视刻度量取蒸馏水,则所配制溶液中,谷氨酸钠的质量分数____(填“偏大”、“偏小”或“无影响”),所测定的味精中NaCI的质量分数___(填“偏大”、“偏小”或“无影响”)。
③精确测定AgCl沉淀质量为2.87 g,则该味精中NaCl的质量分数为___。(计算结果精确到0.1%。有关物质的相对分子质量:NaCl-58. 5 , AgCl-143. 5 )
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小君和小英同学发现:带火星的竹签在空气中不会复燃,若用装有60%水的集气瓶倒置在水槽中收集氧气,得到的气体能使带火星的竹签复燃,为了找到能使带火星竹签复燃的氧气含量最小值,他们进行了如下探究:
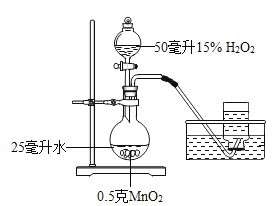
(设计实验)小君设计了如图的装置,该装置的圆底烧瓶中放入25毫升水的目的是____________。
(实验研究)第一组实验:取3只集气瓶,编号为①②③,分别装入15%30%和45%的水,盖上盖玻片倒置在水槽中。当气泡___________________放出后,导管口伸入集气瓶把其中的水全部排出,将相同的3支带火星竹签分别插入①~③号瓶中,记录实验现象。
获得第一组实验现象后,小君又做了第二组实验,并记录实验现象,两组实验数据和现象见下表:
实验分组 | 第一组 | 第二组 | ||||
实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
集气瓶装水的体积分数/% | 15 | 30 | 45 | 34 | 38 | 42 |
带火星竹签状况 | 亮 | 很亮 | 复燃 | 很亮 | 复燃 | 复燃 |
得出上述两组实验现象后,小英认为还不能确定能使带火星竹签复燃的氧气含量最小值,需继续进行实验。则实验序号⑦的集气瓶装水的体积分数应该是_________%。
(实验结论)再经过数次实验并计算后得出:能使带火星竹签复燃的氧气含量最小值为48.7%。
(继续探究)小君认为采用该方法收集的氧气中含有一定量的水蒸气,请你提出实验改进的措施______________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小华同学在探究金属与酸反应时,将铝片、锌片打磨后,分别投入盛有等体积、等浓度稀盐酸的试管中,观察到铝与稀盐酸反应较锌与稀盐酸反应快。
(提出问题)金属与盐酸反应快慢,除与金属的种类有关外,还受哪些因素的影响呢?
(猜想与假设)a.可能与盐酸的浓度有关;b.可能与反应时的温度有关;c.你的猜想是_____。
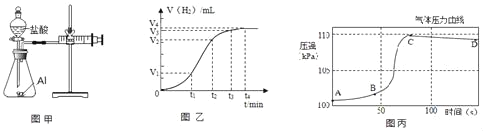
(设计并实验)小明利用如图甲所示装置,用不同质量分数的盐酸和相同形状的铝片进行如下实验。
实验编号 | 盐酸的浓度(均取20mL) | 温度/℃ | 记录的数据 |
① | 5% | 30 | |
② | 10% | 20 | |
③ | 5% | 20 | |
④ | 10% | 30 |
(交流讨论)(1)请写出铝与盐酸反应的化学方程式:_____。
(2)实验前小明先将分液漏斗的活塞关闭,再将注射器活塞往右拉,松手后,观察到注射器活塞回到原处。小明进行该操作的目的是_____。
(分析数据、得出结论)
(3)实验中记录的数据可能是:_____;
对比实验②③可知_____ 对金属与酸反应的速率的影响
(4)实验表明,四次实验时,反应的速率由快到慢依次为④、②、①、③.根据记录的数据分析,如果盐酸质量分数为10%,温度为25℃,则所记录数据应该介于_____两次实验所记录的数据之间。
(拓展延伸)
(5)小明进行铝与稀盐酸反应时,试管外壁发烫,并测得实验过程中生成氢气的体积随时间变化的曲线如图乙所示,根据曲线归纳铝与稀盐酸反应速率的变化规律:_____
(6)研究小组同学对铝和稀盐酸的反应进行再探究。将橡皮塞连接气体压力传感器,烧瓶中放入铝片和稀盐酸,塞紧瓶塞并打开仪器,一段时间后,得到如丙图所示的气体压强与时间的关系曲线图。
AB段气体压力变化不明显的原因是:_____。
CD段气体压力逐渐下降的原因是:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室中同学们进行了如图所示实验,成功探究出了久置氢氧化钠固体的变质情况。下列说法正确的是( )
![]()
A. 甲溶液可以选择稀盐酸或CaC12溶液(查阅资料得知:CaC12溶液显中性)
B. 若Ⅱ、Ⅲ均有明显现象,则说明样品部分变质
C. D物质可能是气体,也可能是沉淀
D. 溶液B中的溶质一定只含有NaOH和甲
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】研究“水”可从多角度展开。
(1)水的电解
①宏观现象:按如图所示装置,通电一段时间后,试管A、B中产生气体的体积比约为_________,检验B中气体的现象是___________。
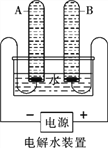
②微观该反应中发生分解的微粒名称是___________。
③结论:水由__________组成。
(2)水的性质
将黄豆大小的金属钾放入盛有水的烧杯中,生成H2;在反应后的溶液中滴入酚酞试液,溶液变红。写出该反应的化学方程式_________。
(3)水的用途
①碘与锌在常温下反应速度很慢,若滴入几滴水则反应剧烈,水在此的作用是_____。
②下列实验中,对水的主要作用分析不全面的是_________(填字母)
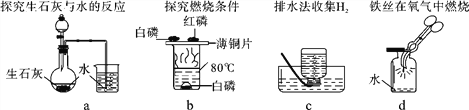
A.a图中的水便于观察烧瓶内气压变化
B.b图中的水提供热量
C.c图集气瓶中的水排尽空气且便于观察H2何时集满
D.d图中的水防止熔融物炸裂集气瓶
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,进行中和反应实验
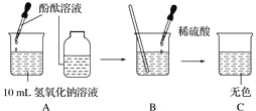
(1)B中发生中和反应的化学方程式_____。
(2)写出C的溶液(除酚酞外)溶质可能存在的几组情况_____(用化学式表示)
(3)反应过程中,不断滴入稀硫酸的话,温度会如何变化?_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国古代将炉甘石(主要成分:ZnCO3)、赤铜矿(主要成分:Cu2O)和木炭粉为原料制得黄铜(铜和锌的合金,外观似黄金),其生产流程如图1:
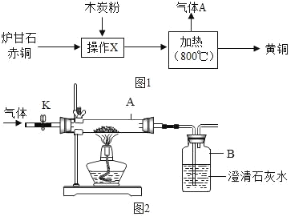
回答下列问题:
(1)赤铜中主要成分Cu2O的铜元素的化合价为_____
(2)加热时,发生的主要反应化学方程式为:①ZnCO3![]() ZnO+CO2↑;②2ZnO+C
ZnO+CO2↑;②2ZnO+C![]() 2Zn+CO2↑;③_____(赤铜和木炭粉反应)
2Zn+CO2↑;③_____(赤铜和木炭粉反应)
(3)某兴趣小组同学对上述反应生成的气体A的成分进行研究.
(提出问题)生成的气体中是否含有一氧化碳?
兴趣小组同学利用图2所示的装置进行实验,对生成的气体成分进行探究.
(实验与讨论)
①打开K,缓缓通入干燥的氮气一段时间.
②关闭K,加热至一定温度使玻璃管中的炉甘石、赤铜和木炭粉反应,用气囊收集气体样品.
③欲除去气体样品中的二氧化碳,并将剩余气体收集在集气瓶中,下列图3装置中最为合理的是_____.
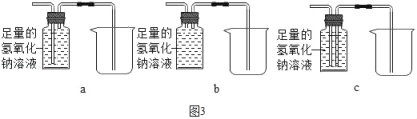
(实验求证)将除尽二氧化碳后的气体样品干燥,仍然用图2所示的装置进行实验,A中的固体应选用_____,B中溶液为澄清石灰水,若A中黑色固体出现了红色,B中澄清石灰水_____,其化学方程式为_____,可说明气体样品中含有一氧化碳.
(实验反思)上述实验中,若生成的气体中含有一氧化碳,则反应时消耗碳、氧元素的质量比_____(填“大于”、“等于”或“小于”)3:8.
(4)另一兴趣小组同学对上述反应生成的固体成分进行了研究.
①甲同学说是铜、锌合金.乙同学说可能是金.
其他的同学否定了乙同学的猜测.其理由是_____.
②为测定该黄铜(铜、锌合金)中铜的质量分数,某兴趣小组取20g黄铜样品放入盛有200g稀硫酸的烧杯中,恰好完全反应,测得烧杯中剩余物质的总质量为219.8g,则:该黄铜样品中铜的质量分数为_____.(计算结果保留0.1%)
③有的兴趣小组用图4装置测定黄铜中铜的质量分数.下列关于该实验的说法正确的是_____
A.分液漏斗与试管间的橡胶管仅有使液体顺利下滴的作用
B.若实验中稀硫酸不足,可以拔下分液漏斗上方的橡皮塞添加
C.该测定还需要的数据是样品质量和此温度、压强下氢气的密度
D.实验结束时,需冷却至室温并将量气管缓缓下移至两侧液面相平再读数
(5)拓展延伸
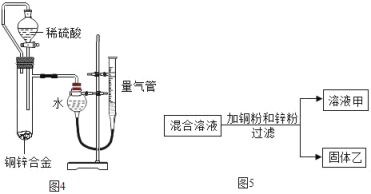
①某化学小组用一定量AgNO3和Al(NO3)3的混合溶液加入铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,如图5所示,则:
a.溶液甲中一定含有Al(NO3)3和Zn(NO3)2
b.固体乙中一定含有Ag,可能含有Cu和Zn
c.若溶液甲是蓝色,则溶液甲一定含有Al(NO3)3、Zn(NO3)2和Cu(NO3)2
d.向固体乙上滴加盐酸有气泡产生,则溶液甲中一定没有AgNO3和Cu(NO3)2
上述四种说法正确的个数为_____
A.1个 B.2个 C.3个 D.4个
②利用废旧电池铜帽(含Cu、Zn)提取Cu,并得到ZnSO4溶液,主要流程如图6,(已知:①反应条件已略去;②2Cu+2H2SO4+O2![]() 2CuSO4+2H2O).
2CuSO4+2H2O).

a.溶液A和固体C都含有_____两种元素,过程Ⅱ、Ⅲ中的分离操作是_____.
b.请写出步骤Ⅲ中发生反应的化学方程式:_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com