
| A. | 酚酞中碳、氢、氧三种元素的质量比为20:14:4 | |
| B. | 酚酞的额相对分子质量为138 | |
| C. | 酚酞中氧元素的质量分数最小 | |
| D. | 酚酞不是氧化物 |
分析 A.根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行解答;
B.根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析;
C.根据化合物中元素质量比的结果来分析;
D.根据氧化物的概念来分析.
解答 解:A.酚酞中碳、氢、氧三种元素的质量比为(12×20):(1×14):(16×4)=120:7:32;故错误;
B.酚酞的相对分子质量12×20+1×14+16×4=318,故错误;
C.酚酞中碳、氢、氧三种元素的质量比为(12×20):(1×14):(16×4)=120:7:32,由此可知,其中氢元素的质量分数最小,故错误;
D.酚酞是由碳、氢、氧三种元素组成的,而氧化物是由两种元素组成的,酚酞不属于氧化物,故正确.
故选D.
点评 本题考查学生对物质分子中所含原子的个数,化合物中各元素质量比,物质中某元素的质量分数的知识理解与掌握,并能在解题中灵活应用的能力.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
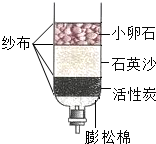 近两年来,我国西南、长江中下游等地先后遭遇大范围持续干旱.我们在抗旱救灾的同时,更应倡导保护水环境、珍惜水资源.请回答下列问题:
近两年来,我国西南、长江中下游等地先后遭遇大范围持续干旱.我们在抗旱救灾的同时,更应倡导保护水环境、珍惜水资源.请回答下列问题:
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 溶液中一定含有水 | B. | 稀溶液一定是不饱和溶液 | ||
| C. | 溶液一定是无色、透明的混合物 | D. | 溶液加水稀释前后溶质的质量不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | X由碳、氢两种元素组成 | B. | X中碳、氢两种元素的质量比为1:2 | ||
| C. | X的相对分子质量是180 g | D. | X中碳元素的质量分数为40% |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com