


 走进文言文系列答案
走进文言文系列答案科目:初中化学 来源:不详 题型:实验题

| 实验操作 | 实验现象 | 实验结论 |
| ①取一定量的白色粉末加热,将产生的气体通入小烧杯中,至无气体产生时,停止加热 (小烧杯内盛有澄清的石灰水) | 试管内壁有无色液滴,石灰水变浑浊,试管内剩余白色固体物质 | 粉末中一定含有 反应的化学方程式是 |
| ②取实验①所剩余白色固体少量于试管中,向试管中加入稀盐酸 | | 实验①所剩余白色固体中一定含有 ; 反应的化学方程式是 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.溶液中一定含FeCl2,固体一定含铜 |
| B.溶液中一定含FeCl2,固体一定是铁和铜 |
| C.溶液中一定含FeCl3,固体一定是铁和铜 |
| D.溶液中一定含FeCl2、CuCl2,固体一定含铜 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液温度 (t)/℃ | 25.2 | 29.6 | 32.0 | 36.0 | 38.2 | 36.7 | 35.7 | 34.7 | 33.7 | 32.9 |
查看答案和解析>>
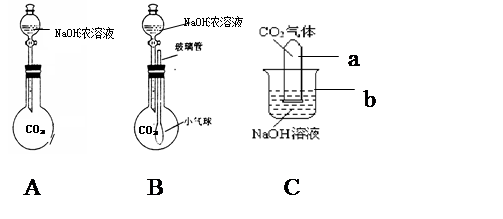
科目:初中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
| Ⅰ | 1.2g | | |
| Ⅱ | 1.2g | CuO 0.5g | |
| Ⅲ | 1.2g | MnO2 0.5g | |

| | 气体发生装置内物质的总质量 |
| 反应前 | 35.6g |
| 反应后 | 34.8g |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

查看答案和解析>>
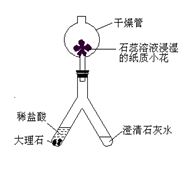
科目:初中化学 来源:不详 题型:实验题

 CaCO3+CO2↑
CaCO3+CO2↑| 该同学的观点 | 你是否赞同该观点并阐述理由 |
| 该实验没有对氧气进行验证 | |
| “结论2”不正确 | |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com