


 备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源: 题型:阅读理解
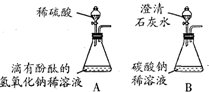
| 实验内容 | 实验现象和结论 |
| 取废液缸中少量溶液于试管中, 滴入少量 Na2CO3 Na2CO3 溶液,观察 | a.若有气泡产生,则猜想 ② ② 成立(填数字代号) |
| b.若无气泡产生,则猜想 ① ① 成立(填数字代号) |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 含钠元素、钙元素的化合物是初中化学的重要研究对象之一.
含钠元素、钙元素的化合物是初中化学的重要研究对象之一.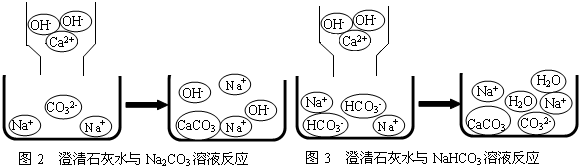
| 实验内容 | 实验现象 | 实验结论 |
| 方案一:取少量滤液加入试 管中,向其中 |
娇娇同学的猜想是正确的. 滤液中含有的两种溶质是 | |
| 方案二:取少量滤液加入试管中,向其中 |
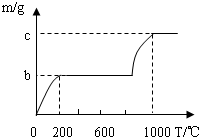 学们认为实验过程中产生的废液必须处理后再排放.请你对B试管中滤液的处理提出可行的建议
学们认为实验过程中产生的废液必须处理后再排放.请你对B试管中滤液的处理提出可行的建议查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 “苹(凭)什么”是继“蒜(算)你狠”、“逗(豆)你玩”之后又一网络流行语,说的是近日苹果价格激增.苹果有“智慧果”、“记忆果”的美称,富含维生素C.以下是有关VC的探究.
“苹(凭)什么”是继“蒜(算)你狠”、“逗(豆)你玩”之后又一网络流行语,说的是近日苹果价格激增.苹果有“智慧果”、“记忆果”的美称,富含维生素C.以下是有关VC的探究.| 实验方法 | 实验现象 | 实验结论 |
| 1取样,滴加紫色石蕊试液 | 溶液显酸性 | |
| ② |
有大量无色气体生成 | 有酸性物质存在 |
| ③取少许氢氧化钠溶液,加入两滴酚酞,再滴加VC溶液 | 有酸性物质存在 |
| 饮料名称 | 滴加果汁滴数 |
| 汇源橙汁 | 47 |
| 农夫果园 | 10 |
| 芬达(橙味) | 大于50滴不褪色 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 浓硫酸(分析纯) 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数:98% |
| 阳离子\阴离子 | OH- | NO3- | Cl- | SO42- | CO32- |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不溶 | 不溶 |
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
除去碳酸钠 |
取少量该固体样品溶于水配成溶液,滴加适量的 充分反应后过滤 |
有白色沉淀生成 |
有关反应的化学方程式为 |
| 检验是否含有氢氧化钠 | 在滤液中滴加酚酞溶液 | 该样品中含有氢氧化钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com