
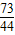 =
=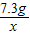 x=4.4g
x=4.4g

 互动英语系列答案
互动英语系列答案科目:初中化学 来源: 题型:
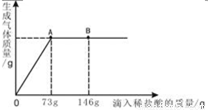
(6分)一烧杯中盛有22.3 g Na2CO3和NaCl组成的固体混合物,加入143.1 g水,溶解,制成溶液.向其中滴加溶质的质量分数为10 %的稀盐酸,生成气体的总质量与所滴入稀盐酸的质量关系如右图所示。
(1)当滴加稀盐酸至图中B点时,溶液中所含溶质是(写化学式)_______。
(2)当滴加了73 g稀盐酸时,计算生成气体的质量(写出必要的计算过程,结果精确到0.1g)。
查看答案和解析>>
科目:初中化学 来源: 题型:
在一烧杯中盛有22.3克碳酸钠和氯化钠组成的固体混合物,向其中逐渐滴加溶质质量分数为10%的稀盐酸(Na2CO3+2HCl=2NaCl+H2O+CO2↑),放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示。请根据题意回答问题:
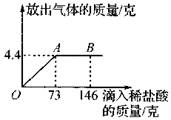
(1)当滴加了73克稀盐酸时,放出气体的总质量为 ▲ 克。
(2)当滴加稀盐酸至图中的B点时,烧杯中溶液里的溶质是(写化学式): ▲ 。
(3)当滴加了73克稀盐酸时(即A点时),烧杯中为不饱和溶液,试通过计算求出此时所得溶液的溶质的质量分数。(准确到0.1%)
查看答案和解析>>
科目:初中化学 来源:2012届浙江省三门初级中学九年级第六次月考化学试卷(带解析) 题型:计算题
在一烧杯中盛有22.3克碳酸钠和氯化钠组成的固体混合物,向其中逐渐滴加溶质质量分数为10%的稀盐酸(Na2CO3+2HCl=2NaCl+H2O+CO2↑),放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示。请根据题意回答问题: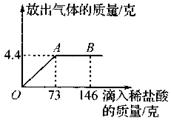
(1)当滴加了73克稀盐酸时,放出气体的总质量为 ▲ 克。
(2)当滴加稀盐酸至图中的B点时,烧杯中溶液里的溶质是(写化学式): ▲ 。
(3)当滴加了73克稀盐酸时(即A点时),烧杯中为不饱和溶液,试通过计算求出此时所得溶液的溶质的质量分数。(准确到0.1%)
查看答案和解析>>
科目:初中化学 来源:2012届度武汉市九年级下学期五月供题化学试卷(解析版) 题型:计算题
(6分)一烧杯中盛有22.3 g Na2CO3和NaCl组成的固体混合物,加入143.1 g水,溶解,制成溶液.向其中滴加溶质的质量分数为10 %的稀盐酸,生成气体的总质量与所滴入稀盐酸的质量关系如右图所示。
(1)当滴加稀盐酸至图中B点时,溶液中所含溶质是(写化学式)_______。
(2)当滴加了73 g稀盐酸时,计算生成气体的质量(写出必要的计算过程,结果精确到0.1g)。
查看答案和解析>>
科目:初中化学 来源:2011-2012学年浙江省九年级第六次月考化学试卷(解析版) 题型:计算题
在一烧杯中盛有22.3克碳酸钠和氯化钠组成的固体混合物,向其中逐渐滴加溶质质量分数为10%的稀盐酸(Na2CO3+2HCl=2NaCl+H2O+CO2↑),放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示。请根据题意回答问题:
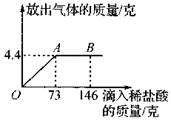
(1)当滴加了73克稀盐酸时,放出气体的总质量为 ▲ 克。
(2)当滴加稀盐酸至图中的B点时,烧杯中溶液里的溶质是(写化学式): ▲ 。
(3)当滴加了73克稀盐酸时(即A点时),烧杯中为不饱和溶液,试通过计算求出此时所得溶液的溶质的质量分数。(准确到0.1%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com