
【题目】某化学小组对人体吸入的空气和呼出气体进行了如下实验探究。
(提出问题)人体吸入的空气与呼出气体组成有什么不同?
(资料)①白磷着火点约40℃;②通常条件下,氢氧化钠溶液与白磷不反应,氢氧化钠溶液可以吸收二氧化碳气体。
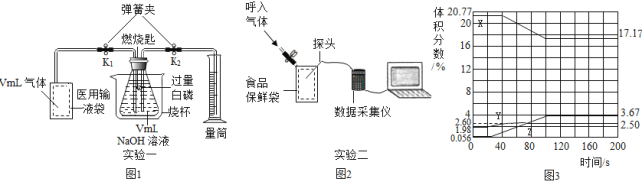
(实验操作)实验一:(如图1)
(1)检查好装置气密性后装入试剂,医用输液袋中收集VmL空气。
(2)打开弹簧夹_______,缓慢将袋中空气全部排入锥形瓶中,读出量筒内收集到液体V1mL.由此测得空气中_____的体积为______mL。
(3)关闭弹簧夹K1、K2,再用_____方法(填具体操作),使燃烧匙内的白磷迅速燃烧,反应的化学方程式为________。充分反应后,冷却至室温,打开K2,量筒内剩余液体为V2mL。由此测得氧气在空气中所占的体积分数可表示为_____。
实验二:(如图2)
(4)把测定氧气、二氧化碳、水蒸气的传感器放入食品保鲜袋,然后向袋内呼出气体。采集的数据经处理如图3所示,表示氧气体积分数变化的_____。(填“X”、“Y”或“Z”)。Y的体积分数在60s之后逐渐减小的原因是_________。
(数据处理)(5)实验二中,200s时没有被采集数据的其他所有气体的总体积分数为____%。
(评价与反思)(6)由实验二分析,人体呼出气体与空气相比,组成上的差异是__________。
【答案】K1、K2 CO2 V-V1 加入热水(热水温度大于40℃) 4P + 5O2![]() 2P2O5
2P2O5 ![]() X 水蒸气冷凝 76.66 氧气含量比空气低,二氧化碳、水蒸气含量比空气高
X 水蒸气冷凝 76.66 氧气含量比空气低,二氧化碳、水蒸气含量比空气高
【解析】
(2)打开弹簧夹K1、K2;缓慢将袋中的空气全部排入锥形瓶中。读出量筒中液体体积为V1 mL,氢氧化钠溶液易与二氧化碳反应生成可以溶于水的碳酸钠和水,锥形瓶中氢氧化钠溶液的作用是吸收气体中的二氧化碳,减少的液体体积等于二氧化碳体积,二氧化碳的体积=V﹣V1;
(3)关闭弹簧夹K1、K2,再向烧杯中加入热水(热水温度大于40℃),以促使白磷迅速燃烧。磷燃烧产生五氧化二磷,化学反应式为4P + 5O2![]() 2P2O5;待瓶中气体冷却至室温,打开K2。量筒中的水倒吸,读出量筒中液体体积为V2mL,反应消耗的氧气体积= V1- V2,测定出的气体成分在空气中所占的体积分数可表示=
2P2O5;待瓶中气体冷却至室温,打开K2。量筒中的水倒吸,读出量筒中液体体积为V2mL,反应消耗的氧气体积= V1- V2,测定出的气体成分在空气中所占的体积分数可表示= ![]() ×100%;
×100%;
(4)由于呼出气体中二氧化碳增多和水蒸气增多,氧气减少。把氧气、二氧化碳、水蒸气(测湿度)探头放入袋中,开始采集数据(如图1),然后向袋内吹入气体,采集的数据经处理得到图3,表示氧气体积分数变化的是X,Y的体积分数在60s后逐渐减小的原因是水蒸气冷凝;
(5)由图示可知:200s时未采集数据的所有气体,总体积分数=100%-17.17%-3.67%-2.50%=76.66%;
(6)人体的新陈代谢需要消耗氧气,同时产生二氧化碳,因此呼出气体中所含的氧气的含量比人体吸入空气中氧气含量低,二氧化碳的含量比人体吸入空气中的二氧化碳多。


科目:初中化学 来源: 题型:
【题目】化学反应都遵守质量守恒定律,请根据质量守恒定律的相关知识完成下列问题:
(1)下列各项中,在化学反应前后一定不变的是_____(填数字序号)。
①元素的种类 ②物质的种类 ③原子的种类 ④分子的种类 ⑤原子的数目 ⑥分子的数目
(2)应用质量守恒定律配平化学方程式:____C2H4+__O2![]() __CO2+____H2O
__CO2+____H2O
(3)实验室常用如左图所示实验验证质量守恒定律.四位同学设计了如图的A、B、C、D四个实验,并按左图的实验操作来验证质量守恒定律,实验中观察到B、C实验前后天平依然保持平衡,某同学认为B、C实验都能验证质量守恒定律,你认为他的说法_______ (填“是”或“否”)正确;而A、D实验天平不平衡,其中D实验天平不平衡的原因是_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列四个图象分别表示对应的四种操作过程,其中正确的是( )
A. 加热氯酸钾制取氧气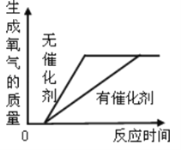
B. 向pH=2的盐酸中不断加水稀释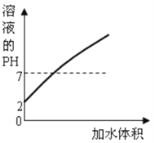
C. 向pH=1的硫酸溶液中逐滴加入pH=13的NaOH溶液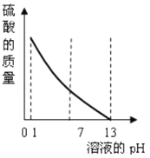
D. 向10.4g10%的BaCl2溶液中逐滴加入10%的Na2SO4溶液 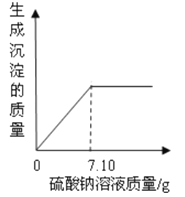
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小林同学在体育课上腿部擦伤,医务室的大夫在她伤口上涂了医用过氧化氢溶液,小林看到伤口处产生了小气泡,很好奇。为什么瓶中的过氧化氢溶液涂到伤口上,分解就加快了呢?

I.小林准备用如下图所示装置测定过氧化氢分解的快慢,实验前在注射器中吸入过氧化氢溶液,量筒内装满水。实验开始时,向试管中注入过氧化氢溶液,并用排水法收集氧气。记录2分钟收集的气体体积。

(1)请写出过氧化氢分解的反应方程式:______________。
(2)若要检验生成的气体是否为氧气,可将导气管从水中取出,取带火星的木条放在导气管口处,观察到__________,说明生成的气体是氧气。
II.小林查阅了相关资料,并进行了探究实验
(查阅资料)
(1)过氧化氢是人体代谢废物之一,它能够对机体造成损害,人体存在过氧化氢酶,可以催化过氧化氢分解。
(2)温度对化学反应的快慢有影响,人体正常体温是37℃。
(提出猜想)猜想1: 过氧化氢分解加快是因为体温比瓶中的温度高。
猜想2:过氧化氢分解加快是因为伤口中有过氧化氢酶。
(进行实验)
序号 | 实验步骤 | 实验现象 | 实验结论 |
① | 分两次进行实验,均注入5 mL过氧化氢溶液 第一次在常温下进行 第二次将试管浸在37℃的温水中 | 量筒中2分钟收集到的气体体积均为5 mL | _____ |
② | 分两次进行实验 第一次将装有一小粒过氧化氢酶的试管浸在37℃的温水中,注入5 mL过氧化氢溶液 第二次__________ | 第一次,量筒中2分钟收集到的气体体积为56 mL 第二次,量筒中2分钟收集到的气体体积为5 mL | 过氧化氢分解加快是因为过氧化氢酶的作用 |
(3)实验①得出的结论是___________。
(4)实验②中第一次收集到的氧气体积为__________ mL。
(5)实验②中横线部分应进行的操作是__________。
(实验反思)
小林反思了实验过程,认为人体中过氧化氢酶是在体温条件下发挥作用的,实验得出的结论可能存在不足。因此又补充进行了几组实验,数据记录如下表所示。
加入过氧化氢酶 | 不加过氧化氢酶 | |||||
反应温度/ ℃ | 25 | 37 | 42 | 25 | 37 | 42 |
收集到气体体积/ mL | 39 | 56 | 34 | 5 | 5 | 5 |
(6)通过这些数据,你能得出的新结论是__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】空气是一种宝贵资源,如利用空气中分离出的氮气合成氨气,合成氨对社会发展和人类进步做出了巨大贡献,下列是合成氨的工艺流程图:
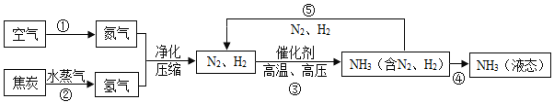
(1)空气属于____(填“纯净物”或“混合物”),空气中氮气的体积分数约为 __%。
(2)用化学用语填空
两个氢分子____ 标出NH3中氮元素的化合价______
氦气__________ 步骤③的反应中没有改变的微粒是__
(3)将沸点不同的气体分离开来,常采用液化分离法。如控制温度在﹣183℃时,可将空气中N2与O2分离。根据下表中物质的沸点判断,要将产物NH3与N2、H2分离开来,温度应该控制在___℃。
物质 | H2 | N2 | O2 | NH3 |
沸点 | ﹣252℃ | ﹣195.8℃ | ﹣183℃ | ﹣33.35℃ |
(4)图中所标出的①②③的变化中,其中属于物理变化的过程是____,流程中能循环使用的物质是___(填名称)。
(5)写出N2、H2反应生成NH3的化学方程式_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组利用下列装置进行气体的制取实验,请回答下列问题.
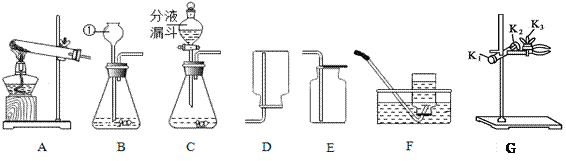
(1)写出标号①仪器的名称___________.
(2)用高锰酸钾制取和收集较纯净的氧气,选择的装置组合是___(填字母)写出反应的化学方程式______________________________,实验后发现制得的氧气不纯,可能的原因是_________________________.(答一点即可)
(3)如图G,要调节夹持试管的铁夹的松紧,应调节旋钮___(填“K1”“K2”或“K3”)。
(4)实验室制取二氧化碳的化学方程式______________________,与B相比,C作为制取二氧化碳的发生装置,优点是_______________,验证二氧化碳收集满的方法是______________________________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如下表中数据为氯化钠和硝酸钾在不同温度时的溶解度,如图所示是用其中一种物质所做的实验。下列分析正确的是( )

温度(℃) | 10 | 20 | 30 | 40 | |
溶解度/g | KNO3 | 20.9 | 31.6 | 45.8 | 63.9 |
NaCl | 35.8 | 36.0 | 36.3 | 36.6 | |
A. 实验中加入的物质R是氯化钠 B. ④中t的取值范围在30~40之间
C. ③中的溶液可能是饱和溶液 D. ④中溶液的溶质质量分数可能比②中的大
查看答案和解析>>
科目:初中化学 来源: 题型:
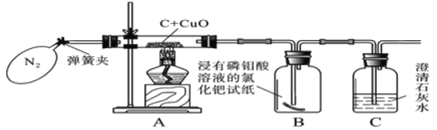
【题目】同学们在学习碳的化学性质之后得知碳燃烧时可能生成二氧化碳,也可能生成一氧化碳,某化学兴趣小组对木炭还原氧化铜可能生成的气体成分进行实验探究。
(提出问题)碳与氧化铜反应可能生成什么气体?
(提出猜想)猜想①:只生成CO2; 猜想②:____________; 猜想③:既生成CO,又生成CO2
(查阅资料)浸有磷钼酸溶液的氯化钯试纸遇CO2无变化,但遇微量的CO也会立即变成蓝色。
(实验验证)小组同学经过思考之后,设计了如图所示的实验装置:
步骤一:打开弹簧夹,先通一会儿纯净干燥的氮气;
步骤二:关闭弹簧夹,点燃酒精灯对玻璃管加热。
步骤三:实验结束后,拆洗装置和仪器。
(1)实验开始时,先将氮气通入实验装置一段时间再加热的目的是_____________;
(2)对A装置的玻璃管集中加热一段时间,玻璃管中黑色粉末逐渐变成红色,B瓶中试纸变蓝,C中澄清石灰水变浑浊。
(实验结论)
(3)通过对实验现象的分析,上述猜想________(填序号)是正确的。
(实验反思)
(4)请从环保的角度分析,实验装置中存在不完善之处是____________。
(拓展应用)实验结束后,同学们发现玻璃管内壁附着的铜用水不易清洗干净,通过查阅资料获得三种能清除铜的方案:
Ⅰ.加入浓硫酸并微热:Cu + 2H2SO4(浓)![]() CuSO4+ SO2↑+ 2H2O
CuSO4+ SO2↑+ 2H2O
Ⅱ.加入浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2+2NO2↑+ 2H2O
Ⅲ.加入氯化铁溶液:Cu + 2FeCl3= 2FeCl2+ CuCl2
(5)为了将试管内壁上附着的铜清洗干净,上述最佳的方案是__(填序号)理由是___________(写一种合理的理由即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】葡萄糖酸钙片是一种常用补钙剂,其主要成分葡萄糖酸钙的化学式为(C6H11O7)2Ca。请回答下列问题:
(1)葡萄糖酸钙的相对分子质量为____。
(2)葡萄糖酸钙中C:H:O:Ca的质量比为____。
(3)通常说的补“钙”,是指补充钙____(填“元素”、“原子”、“单质”、“离子”)。
(4)如图是某钙片使用说明书的部分内容。某成人服用该钙片,每日3次,每次1片,相当于1每日摄入钙____克(精确到0.01g)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com