
【题目】某化学兴趣小组同学探究铁的冶炼相关问题,请按要求回答下列问题。
(一)如是工业炼铁的主要装置

(1)图中设备的名称是________ 。
(2)工业炼铁在生产过程中需将铁矿石、焦炭、石灰石粉碎,其目的是_______ 。加入的焦炭作用__________和________,所得产品生铁的含碳量为________。
(3)写出以赤铁矿为原料在高温下制取铁的化学方程式:________ 。
(二)下如图为实验室模拟工业炼铁装置图:已知B装置中的液体为过量的氢氧化钠与氢氧化钙混合液,氢氧化钠吸收二氧化碳能力比氢氧化钙强。如果实验成功,请回答下列问题:
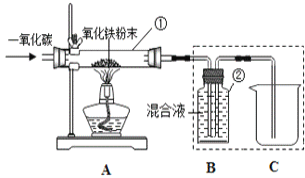
(4)图中仪器①的名称为_________。
(5)实验过程中的现象:A中________ 、B中________ 。
(6)该实验的操作步骤:________。(填序号)
a.点燃A处酒精灯 b.通入CO气体 c.停止通入CO气体 d.熄灭酒精灯
(7)兴趣小组同学们采集了用热分析仪记录的CO与Fe2O3进行反应时的有关数据,并得到固体质量与反应温度的关系曲线。已知原固体质量为48.0g,如图所示:

①根据图象分析,写出B点时固体成分的化学式________。
②若A点生成物为一成分固定的化合物,请确定其化学式是 _______。
(8)若某同学实验中,发现吸收的二氧化碳质量为0.55g。则仪器①中固体减轻的质量为________g。
(9)实验装置图中采用虚线框内的装置,其作用 ______(填序号字母)。
A.收集一氧化碳 B.吸收二氧化碳 C.检验二氧化碳
【答案】高炉 增大接触面面积,加快反应速率 提高炉温 提供CO 2%—4.3% Fe2O3+3CO ![]() 2Fe+3CO2 硬质玻璃管 红色固体变为黑色 溶液变浑浊 badc Fe Fe3O4 0.2 ABC
2Fe+3CO2 硬质玻璃管 红色固体变为黑色 溶液变浑浊 badc Fe Fe3O4 0.2 ABC
【解析】
本题考查一氧化碳还原氧化铁,常见的金属冶炼,化学式的相关计算,质量守恒定律及其应用,化学方程式的书写。
(1)由图可知,设备是炼铁高炉;
(2) 工业炼铁在生产过程中需将铁矿石、焦炭、石灰石粉碎,其目的是增大与反应物的接触面积,加快反应速率;
焦炭的作用:一、可以与氧气反应放出热量,提供热量,二、可以将自身转化为一氧化碳,提供还原剂CO;
生铁的含碳量为2%-4.3%;
(3)赤铁矿主要成份是Fe2O3,与还原剂一氧化碳反应生成铁和二氧化碳,化学方程式为:Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
(4)由图可知,仪器①的名称为:硬质玻璃管;
(5) A中现象是红色氧化铁粉末被还原为黑色粉末;
B中现象是澄清溶液变浑浊;
(6) 该实验的操作步骤:先通一氧化碳将硬质玻璃管中空气排尽,防止加热时爆炸,再点燃A处酒精灯,实验结束时,先熄灭酒精灯,继续通一会一氧化碳在停止,防止还原出的铁继续被氧化,故此空填:badc;
(7) 由铁的氧化物有:FeO、Fe304、Fe2O3,在一定的条件下,均能够逐步失去其中的氧,最终被还原为铁,可知在800℃以上时,管内固体质量不再减少,说明只有Fe了;
48gFe2O3样品中Fe的质量为:![]() =33.6g,剩余黑色固体中氧元素的质量=46.4克-33.6克=12.8克,黑色固体中Fe、O原子的个数比为:
=33.6g,剩余黑色固体中氧元素的质量=46.4克-33.6克=12.8克,黑色固体中Fe、O原子的个数比为:![]() =3:4,所以,固体B的化学式为:Fe3O4
=3:4,所以,固体B的化学式为:Fe3O4
(8) 仪器①中减少的是氧元素的质量,二氧化碳中氧元素的质量为:0.55g×![]() =0.4g,二氧化碳中有一个氧原子来自金属氧化物,所以仪器①中固体减轻的质量为0.2g;
=0.4g,二氧化碳中有一个氧原子来自金属氧化物,所以仪器①中固体减轻的质量为0.2g;
(9) 氢氧化钠、氢氧化钙会与二氧化碳反应,一氧化碳有毒,需要处理,所以实验装置图中采用虚线框内的装置,其作用有:收集一氧化碳,吸收二氧化碳,检验二氧化碳,故选:ABC。


科目:初中化学 来源: 题型:
【题目】甲、乙、丙是三个实验的示意图,根据下图中所发生的化学反应现象及化学反应原理,进行总结归纳并回答下列问题:
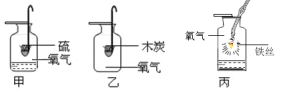
(1)依据甲实验回答:
①硫在氧气中燃烧的现象是___________________;
②硫在氧气中燃烧的文字表达式_______________。
(2)甲、丙实验集气瓶中均放少量水,甲放水的目的是_______,丙放水的目的是________。
(3)小明做完上述实验后,在乙中加入澄清石灰水,目的为验证___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用化学用语填空。
(1)氩气__,2个铵根离子____,3个镁离子____,2个过氧化氢分子____;
(2)某气体在空气中占78%(体积百分含量),保持它的化学性质的最小粒子是___;
(3)地壳中含量最多的金属元素形成的离子______;
(4)NH4NO3中划线氮元素的化合价__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在“宏观-微观”之间建立联系,是学习化学学科必备的思维方式,如图是某反应的微观示意图,下列说法正确的是( )
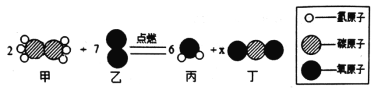
A. 该反应属于分解反应 B. 参加反应的甲、乙的质量比为60:224
C. 反应生成丙、丁分子个数比为3:1 D. 该反应前后氧元素的化合价不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国著名化学家张清莲教授在1991年测定了铟元素的相对原子质量最新值。如图是铟元素在元素周期表中的信息,据此信息下列说法错误的是( )
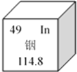
A. 铟原子的原子核中有49个中子 B. 铟原子的相对原子质量为114.8
C. 铟原子核外有49个电子 D. 铟元素是一种金属元素
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在进行实验操作常用到下列基本操作,下列说法正确的是

A. 操作①和⑤中玻璃棒的作用是相同的
B. ①④⑤组合可以完成粗盐中难溶性杂质的去除实验
C. 在进行操作⑤时,将水全部蒸发后停止加热
D. 配制溶质质量分数一定的溶液时,在操作③时,若俯视读数,会使所配制溶液的溶质质量分数偏小
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动,请你和他们一起完成以下实验探究。
(演示实验)将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中,该反应的化学方程式是________。
(查阅资料)溶液显中性
(提出问题)实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
(猜想与假设)针对疑问,甲组同学猜想如下:
猜想Ⅰ:只有CaCl2;
猜想Ⅱ:有______;
猜想Ⅲ:有CaCl2和Ca(OH)2;
猜想Ⅳ:有CaCl2、HC1和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想Ⅳ不合理,其理由是____________
(实验探究)为了验证其余猜想,各小组进行了下列三个方案的探究。
实验方案 | 滴加紫色石蕊溶液 | 通入 | 滴加溶液 |
实验操作 |
|
|
|
实验现象 | ______ | ______ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
(得出结论)通过探究,全班同学一致确定猜想Ⅲ是正确的。
(评价反思)丙组同学认为滴加溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因______。在分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还需要考虑______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】从含FeSO4和CuSO4的废液中回收Cu并制FeSO47H2O实验方案如下:

(1)金属X应选用_______(填序号)。a.Zn b.Cu c.Fe
(2)操作a、b中所用玻璃仪器有:烧杯、_______、玻璃棒。
(3)证明所加稀硫酸过量的方法是:取操作b所获固体,加入__________,无现象。
(4)用加热方法干燥固体,所得Cu不纯,原因是___________(用化学方程式表示)。
上述所制产品中FeSO4质量_______(填“大于”、“小于”或“等于”)原废液中的FeSO4。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com