
| A. | 碱石灰增重质量为6.6g | |
| B. | 混合气体中一氧化碳质量为1.4g | |
| C. | 混合气体中碳、氢元素的质量比为9:2 | |
| D. | 混合气体中两种气体分子数之比为1:1 |
分析 根据在化学反应中遵循质量守恒定律,即反应前后元素的种类、质量不变进行分析.
解答 解:A、甲烷中碳元素的质量为(1.6g-0.4g)1.2g,一氧化碳中碳元素的质量为1.4g×$\frac{12}{28}$×100%=0.6g,即碳元素的质量为1.8g,因此产生二氧化碳的质量为1.8g÷
($\frac{12}{44}$×100%)=6.6g,因此碱石灰增重6.6g,故说法正确;
B、根据题意“测得浓硫酸增重3.6g 则生成3.6克水”,因此氢元素的质量为:3.6g×$\frac{2}{18}$×100%=0.4g;此氢元素的质量,全部来自甲烷,则可知甲烷的质量为:0.4g÷($\frac{4}{16}$×100%)=1.6g.则一氧化碳质量为3.0g-1.6g=1.4g,故说法正确;
C、碳元素和氢元素的质量为1.8g:0.4g=9:2,故说法正确;
D、甲烷和一氧化碳的分子个数比为$\frac{1.6g}{16}$:$\frac{1.4g}{28}$=2:1,故说法错误;
故选项为:D.
点评 本题主要考查学生运用质量守恒定律解答问题的能力.运用质量守恒定律判断物质中含有的元素,是有关质量守恒定律的题目中常见的类型,解题的关键是正确理解质量守恒定律关于反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | KOH、Ba(OH)2、NaCl | B. | NaNO3、HCl、CaCl2 | C. | NaOH、HCl、NaCl | D. | NaOH、HCl、H2SO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 洒水车在路面洒水降尘 | B. | 禁止露天焚烧秸秆 | ||
| C. | 建筑工地要覆盖防尘膜 | D. | 大力发展火力发电 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 碳酸氢铵与氢氧化钙混合使用,既可以增加肥效又可以改良酸性土壤 | |
| B. | 燃烧伴随着发光、放热现象,有发光、放热现象的就是燃烧 | |
| C. | 喝下汽水后常会打嗝,说明气体的溶解度一般随温度的升高而减小 | |
| D. | 氨气能使湿润的蓝色石蕊试纸变红 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用玻璃棒将肥皂水滴到pH试纸上,试纸由黄色变为红色 | |
| B. | 铜片投入到稀硫酸中产生大量的气泡 | |
| C. | 硫在空气中燃烧产生微弱的淡蓝色火焰,并生成无色有刺激性气味的气体 | |
| D. | 打开盛放浓盐酸的试剂瓶盖,瓶口有白烟 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
方案 | 实验操作 | 实验现象 | 结论 |
| 取少量滤液于试管中,在滤液中加入适量的稀盐酸. | 无白色沉淀生成 | 猜想①成立 | |
| 有白色沉淀生成 | 猜想②成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
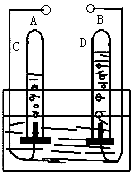 根据电解水实验装置图回答下列问题:
根据电解水实验装置图回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com