
����Ŀ������ͭ�ڷ�֯��ӡˢ����ҵ�й㷺��;��
��1����ҵ�Ͽ���ͭм��������ϡ������80���������Ʊ�����ͭ�� 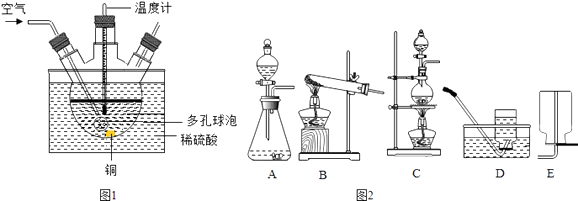
����ͼ1��ʵ����ģ�ҵ�Ʊ�����ͭ��װ�ã���Ӧ�Ļ�ѧ����ʽΪ �� ����ˮԡ���ȵ��ŵ��� �� ������ݵ�����Ϊ ��
�ڹ�ҵ����ʱ���ô��������������һ��ʩ�ܼӿ췴Ӧ�����⣬�����е��ŵ�����ʵ������H2O2��Һ��MnO2�Ʊ�O2 �� ��Ӧ�Ļ�ѧ����ʽΪ �� ��ͼ2�У�Ӧѡ�õķ���װ��Ϊ������ţ���ͬ�����ռ�װ��Ϊ ��
��2����CuSO4Ϊԭ���Ʊ���ʽ̼��ͭ[Cu2��OH��2CO3]�Ĺ�����ͼ3�� 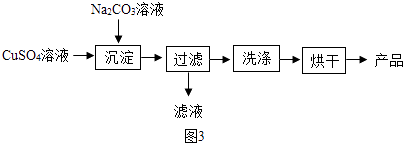
�١�������ʱ�ķ�ӦΪ��2CuSO4+2Na2CO3+H2O=Cu2��OH��2CO3��+2+CO2��
�ڼ�������Ƿ�ϴ�Ӹɾ�ѡ�õ��Լ������ѧʽ�������ʱ��Ʒ�г���������ɫ���ʣ����ܵ�ԭ��Ϊ ��
�������ò�Ʒ�IJ��ʣ�����= ![]() ��100%��ƫ�ߣ�����ܵ�ԭ��Ϊ������ţ�
��100%��ƫ�ߣ�����ܵ�ԭ��Ϊ������ţ�
a����Ӧ��Ϊ��ȫ���� b������ʱ��ֽ����
c��Cu2��OH��2CO3δϴ�Ӹɾ� d��Cu2��OH��2CO3Ϊ��ȫ���
�ܡ�������ʱ��������5Cu��OH��22CuCO3���ɣ����Ʒ��ͭԪ�ص������������ƫ�����䡱��ƫС����
��3��T��ʱ����32.0g����ͭ��һ��ʱ���õ�15.2gCuO��Cu2O�Ļ�������û������CuO��������д��������̣�
���𰸡�
��1��2Cu+O2+2H2SO4 ![]() 2CuSO4+2H2O���¶��أ����Ⱦ��ȣ�������������Һ�ĽӴ������ʹ��Ӧ��ֽ��У��ų���������ĸ��ţ�2H2O2
2CuSO4+2H2O���¶��أ����Ⱦ��ȣ�������������Һ�ĽӴ������ʹ��Ӧ��ֽ��У��ų���������ĸ��ţ�2H2O2 ![]() 2H2O+O2����A��D
2H2O+O2����A��D
��2��Na2SO4��HNO3��BaCl2��Һ����ʽ̼��ͭ���ȷֽ�Ϊ����ͭ��cd��ƫ��
��3���⣺��Ӧǰ��ͭԪ�ص�������ȣ�
��û������CuO������Ϊx����Cu2O������=15.2g��x
32g�� ![]() =x��
=x�� ![]() 100%+��15.2g��x����
100%+��15.2g��x���� ![]() ��100%
��100%
x=8g
���������⣺��1����ͭ�������������ڼ��ȵ������·�Ӧ��������ͭ��ˮ����ѧ����ʽΪ��2Cu+O2+2H2SO4 ![]() 2CuSO4+2H2O��ֱ�Ӽ����¶ȹ��ߣ���Ӧ�¶����Կ��ƣ�ˮԡ���ȣ���Ӧ���¶Ⱥܺÿ��ƣ����Ⱦ��ȣ�ͼ�ж�����ݵ������ǣ�������������Һ�ĽӴ������ʹ��Ӧ��ֽ��У��ڹ�ҵ����ʱ���ô��������������һ��ʩ�ܼӿ췴Ӧ�����⣬�����е��ŵ����ų���������ĸ��ţ�����˫��ˮ������Ӧѡ�õ���ȡװ���ǹ�Һ�����ͣ��ռ�������������ˮ��Ҳ���������ſ���������Ӧ�Ļ�ѧ����ʽΪ��2H2O2
2CuSO4+2H2O��ֱ�Ӽ����¶ȹ��ߣ���Ӧ�¶����Կ��ƣ�ˮԡ���ȣ���Ӧ���¶Ⱥܺÿ��ƣ����Ⱦ��ȣ�ͼ�ж�����ݵ������ǣ�������������Һ�ĽӴ������ʹ��Ӧ��ֽ��У��ڹ�ҵ����ʱ���ô��������������һ��ʩ�ܼӿ췴Ӧ�����⣬�����е��ŵ����ų���������ĸ��ţ�����˫��ˮ������Ӧѡ�õ���ȡװ���ǹ�Һ�����ͣ��ռ�������������ˮ��Ҳ���������ſ���������Ӧ�Ļ�ѧ����ʽΪ��2H2O2 ![]() 2H2O+O2������2���ٷ�Ӧǰ��2��ͭԭ�ӡ�2����ԭ�ӡ�15����ԭ�ӡ�2��̼ԭ�ӡ�4����ԭ�Ӻ�2����ԭ�ӣ���Ӧ��2��ͭԭ�ӡ�0����ԭ�ӡ�7����ԭ�ӡ�2��̼ԭ�ӡ�0����ԭ�Ӻ�2����ԭ�ӣ����ݻ�ѧ��Ӧǰ��ԭ�ӵ�������������֪��2X����4����ԭ�ӡ�2����ԭ�ӡ�8����ԭ�ӣ�����X��ѧ��ΪNa2SO4���ڹʼ�������Ƿ�ϴ�Ӹɾ����ɼ�����������ӵĴ��ڣ�Ӧѡ���Լ��� HNO3��BaCl2��Һ�����ʱ��Ʒ�г���������ɫ���ʣ����ܵ�ԭ��Ϊ��ʽ̼��ͭ���ȷֽ�Ϊ����ͭ���������ò�Ʒ�IJ��ʣ�����=
2H2O+O2������2���ٷ�Ӧǰ��2��ͭԭ�ӡ�2����ԭ�ӡ�15����ԭ�ӡ�2��̼ԭ�ӡ�4����ԭ�Ӻ�2����ԭ�ӣ���Ӧ��2��ͭԭ�ӡ�0����ԭ�ӡ�7����ԭ�ӡ�2��̼ԭ�ӡ�0����ԭ�Ӻ�2����ԭ�ӣ����ݻ�ѧ��Ӧǰ��ԭ�ӵ�������������֪��2X����4����ԭ�ӡ�2����ԭ�ӡ�8����ԭ�ӣ�����X��ѧ��ΪNa2SO4���ڹʼ�������Ƿ�ϴ�Ӹɾ����ɼ�����������ӵĴ��ڣ�Ӧѡ���Լ��� HNO3��BaCl2��Һ�����ʱ��Ʒ�г���������ɫ���ʣ����ܵ�ԭ��Ϊ��ʽ̼��ͭ���ȷֽ�Ϊ����ͭ���������ò�Ʒ�IJ��ʣ�����= ![]() ��100%��ƫ�ߣ�����ܵ�ԭ��Ϊ a����Ӧ��Ϊ��ȫ��������Ӱ�죻
��100%��ƫ�ߣ�����ܵ�ԭ��Ϊ a����Ӧ��Ϊ��ȫ��������Ӱ�죻
b������ʱ��ֽ���𣬲�Ʒ��ʵ���������٣����ò�Ʒ�IJ��ʽ��ͣ�
c��Cu2��OH��2CO3δϴ�Ӹɾ� ��Ʒ��ʵ�������������ò�Ʒ�IJ���ƫ�ߣ�
d��Cu2��OH��2CO3Ϊ��ȫ��ɣ����ò�Ʒ�IJ���ƫ�ߣ��ܡ�������ʱ��������5Cu��OH��22CuCO3���ɣ����Ʒ��ͭԪ�ص���������ƫ��
�����㾫����������������ȡװ�ú��������ռ���������Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪����װ�ã��̹̼����͡���Һ�������ͣ��ռ�װ�ã��������ʵ��ܶȡ��ܽ��ԣ���ˮ���ռ�ʱ�������ݾ�������ð��ʱ���ռ����տ�ʼ�ų������Թ��еĿ����������ſ������ռ�����ʱ�������쵽����ƿ�ײ���


 �ݾ�ѵ������ϵ�д�
�ݾ�ѵ������ϵ�д� С����ȫ�ܼ��ϵ�д�
С����ȫ�ܼ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д�����з�Ӧ�Ļ�ѧ����ʽ��
��1��ˮ���
��2����˿��������ȼ��
��3�����ɴ������̵Ļ�ѧ��Ӧ
��4�������д̼�����������ķ�Ӧ
��5����������غͶ���������ȡ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ij��ѧ��Ӧ���̵���ʾ��ͼ�������й�˵����ȷ���ǣ� �� 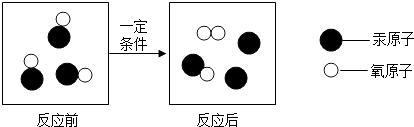
A.��Ӧǰ����ӵĸ�������
B.������������
C.��Ӧǰ��ԭ�Ӻ���ԭ�ӵĸ�������
D.�����������ɷ��ӹ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������¶���ڿ����У�û�з�����ѧ�仯������������ǣ� ��
A. Ũ���� B. Ũ���� C. ��ʯ�� D. ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ƽ��ȡ10.3gʳ�Σ����ָ������ƫ��Ӧ��ȡ�Ĵ�ʩ��
A���ƶ����� B������������ C������ҩƷ D������ҩƷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��̽��ȼ��������ʵ��װ�ã��йظ�ʵ���˵������ȷ���ǣ� �� 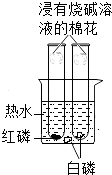
A.ֻ������Թ��еĺ�����ȼ��
B.ֻ���Ҳ��Թ��еİ�����ȼ��
C.��ȼ�յķ�Ӧ����������Ӧ
D.�ռ���Һ������������ȼ�ղ��������Ⱦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������γ��е�֧�����ò�ҵ֮һ���������������Ҫ�õ�����������ͭ�����Ƚ������ϣ��밴Ҫ����գ�
��1�������������õ����Ľ��������Ǹ֣�������ǡ����ǡ��������������������������ۣ����ҿ���Ч��ֹ�������Ӵ������⣮������ԭ��������һ����̼����������Ӧ��ԭ��������Ӧ�Ļ�ѧ����ʽΪ ��
��2��������·�еĵ��ߴ���ͭо�ģ�����Ҫ��������ͭ���ԣ�����ͭ����Ҫ�ɷ�Cu2O���ͻ�ͭ����Ҫ�ɷ�Cu2S����ϱ��տɵõ�ͭ���뽫��Ӧ�ķ���ʽ����������2Cu2O+Cu2S ![]() 6Cu+ ��
6Cu+ ��
��3������ͭ�������������ڵؿ��еĺ�������˳��ΪAl��Fe��Cu�������ֽ���������ֺ����õ�ʱ����ͭ���磬����������������ǵ��йأ������кܺõĿ���ʴ���ܣ�ԭ���� ��
��4��þ���Ͻ������������е���Ҫ����֮һ��Ϊ�ⶨijþ���Ͻ�ֻ��þ��������Ԫ�أ�����ɳɷ֣�ijѧϰС��ȡ3.9g�Ͻ��ĩ����100.0g�����������У����ַ�Ӧ�����Һ�м������20.0%������������Һ�����յõ�����2.9g��
�����ɡ�ͨ�����ۣ������Ϊ�õ��ij����������ݿ��������⣮�����л�ѧ����֪ʶ���㣬��������������Ϊ g��
��5����̽�֡�������ʦ��̣�ͬѧ���˽��������������������������Һ��Ӧ�����������Ե�ƫ�����ƣ���Ӧ���£�NaOH+Al��OH��3�TNaAlO2+2H2O
�����㡿����֪�����������������������������Һ��������ϵ��ͼ��ʾ������㣺
�ٸúϽ���þ������Ϊ g����������Ϊ g��
�ڼ��������������������Ϊ����������д��������̣�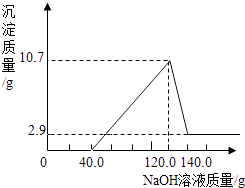
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС��ͬѧ��̽��NaOH��Һ��CO2����ķ�Ӧ�������ͼ��ʾʵ��װ�ã�
��1��������a��b���ӣ�����Һ©���е�NaOH��Һע����ƿ���رշ�Һ©���ϵĻ�������Ȼ������ϵĻ������۲쵽��ʵ�������� �� CO2��NaOH��Ӧ�Ļ�ѧ����ʽ����
��2��̽����Ӧ����ƿ����Һ�����ʵijɷ֣� ��֪Na2CO3+H2O+CO2�T2NaHCO3
NaHCO3+NaOH�TNa2CO3+H2O
��������롿��NaOH��Na2CO3������
��NaHCO3������Na2CO3��NaHCO3 ��
��3�����������ϡ���Ca��OH��2��Na2CO3��NaHCO3���ܷ�Ӧ���а�ɫ�������ɣ� ��CaCl2��Na2CO3�ܷ�Ӧ���а�ɫ�������ɣ���NaHCO3����Ӧ��
��NaHCO3��Һ�Լ��ԣ������ᷴӦ����CO2���壮
�����ʵ�顿��ѡ�Լ���Ca��OH��2��Һ��CaCl2��Һ��ϡ���ᡢ��̪��Һ��
ʵ����� | ʵ������ | ʵ����� |
1��ȡ������Ӧ����Һ���Թ��У����������� | ������ɫ���� | ������� |
2�������������û������ˣ�����Һ�м��������� | ��������� |
����չӦ�á����뵽��������CO2 �� ����ʵ�����е�����������ҺӦ���森
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ�����X��ת����ϵ��ͼ��ʾ����Ӧ�����Ͳ��ֲ�������ȥ����������ʾһ��ת���������и����У���������ͼʾת����ϵ���ǣ� �� 
�� | �� | �� | X | |
A | ������ | ������ | ���� | ���� |
B | �� | �� | ������ | ������ |
C | �� | �� | �� | ������ |
D | ���� | �� | �� | �� |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com