
【题目】小红对暗紫色粉末A进行实验,实验过程如图所示。请回答下列问题
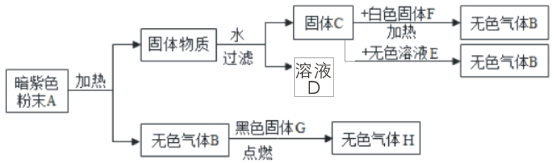
(1)写出下列物质的化学符号:A_____,E_____,F_____,G_____。
(2)写出A受热分解的化学符号表达式:_____;
(3)黑色固体G在无色气体B中得到H的化学符号表达式:_____,检验气体H的方法是_____。
【答案】KMnO4 H2O2 KClO3 C 2KMnO4![]() K2MnO4+MnO2+O2↑ C+O2
K2MnO4+MnO2+O2↑ C+O2![]() CO2 将气体通入澄清石灰水中,澄清石灰水变浑浊
CO2 将气体通入澄清石灰水中,澄清石灰水变浑浊
【解析】
根据暗紫色的粉末A加热生成无色气体B,B和黑色固体G点燃生成无色气体H,所以B是氧气,G是碳,H是二氧化碳,A是高锰酸钾,高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,所以C是二氧化锰,二氧化锰和E、F都会生成氧气,所以F是氯酸钾,E是过氧化氢溶液,然后将推出的物质进行验证即可。
(1)暗紫色的粉末A加热生成无色气体B,B和黑色固体G点燃生成无色气体H,所以B是氧气,G是碳,H是二氧化碳,A是高锰酸钾,高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,所以C是二氧化锰,二氧化锰和E、F都会生成氧气,所以F是氯酸钾,E是过氧化氢溶液,经过验证,推导正确,所以A是KMnO4,E是H2O2,F是KClO3,G是C;
(2)A受热分解的反应是高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,化学方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
(3)黑色固体G在无色气体B中得到H的反应是碳和氧气在点燃的条件下生成二氧化碳,化学方程式为:C+O2![]() CO2,检验气体H的方法是将气体通入澄清石灰水中,澄清石灰水变浑浊。故答案为:(1)KMnO4,H2O2,KClO3,C;(2)2KMnO4
CO2,检验气体H的方法是将气体通入澄清石灰水中,澄清石灰水变浑浊。故答案为:(1)KMnO4,H2O2,KClO3,C;(2)2KMnO4![]() K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
(3)C+O2![]() CO2,将气体通入澄清石灰水中,澄清石灰水变浑浊。
CO2,将气体通入澄清石灰水中,澄清石灰水变浑浊。


科目:初中化学 来源: 题型:
【题目】如图是“铁丝在氧气中燃烧”的实验改进装置。下列说法有错误的是![]()
![]()
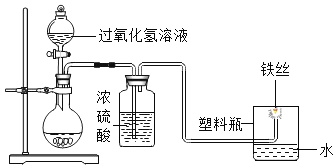
A. 氧气无须提前制备和收集
B. 用塑料瓶代替集气瓶,实验更安全
C. 该装置也可用于二氧化碳的制备、干燥和检验
D. 铁丝在氧气中剧烈燃烧,火星四射,产生白色固体,放出大量的热
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,B为黑色固体,D为红色固体单质,F为红色固体化合物,回答:
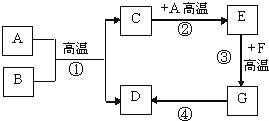
(1)写出下列物质的化学式:
B_____,C_____,D_____,E_____,F_____,
(2)反应③的化学方程式为:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向氧化铜和铁粉的混合物中加入一定量稀硫酸,充分反应后过滤,向滤渣中滴入稀硫酸,有气泡产生。下列判断正确的是( )
A. 滤渣中不可能含有CuB. 滤渣中不可能只含有Fe
C. 滤液中可能含有![]() D. 滤液中可能含有
D. 滤液中可能含有![]()
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列叙述完全符合质量守恒定律的是( )
A. 水结成冰前后,质量保持不变
B. 50mL水和50mL乙醇混合后总体积小于100mL
C. 1.2g硫与1.2g氧气恰好完全反应可生成2.4g二氧化硫
D. 1.2g碳与1.2g氧气恰好完全反应可生成2.4g二氧化碳
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“尾气催化转换器”将汽车尾气中的有毒气体转变为无毒气体。其微观过程如图所示,其中不同的圆球代表不同的原子。以下说法中正确的是
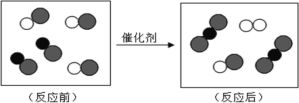
A. 生成物全部是化合物 B. 反应后原子数目减少了
C. 反应后分子数目减少了 D. 参加反应的两种分子个数比为3:2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上用电解NaCl溶液的方法来制取NaOH、Cl2和H2,反应的化学方程式为: 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,现取一定质量分数的NaCl溶液87.3g进行电解,当NaCl完全反应时,生成0.2g的氢气。
2NaOH+H2↑+Cl2↑,现取一定质量分数的NaCl溶液87.3g进行电解,当NaCl完全反应时,生成0.2g的氢气。
(1)当NaCl完全反应时,生成Cl2的质量为_________g。
(2)当NaCl完全反应时,所得NaOH溶液中溶质的质量分数为多少______?(假设气体全部逸出 )
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】完成下列化学方程式并回答有关问题:
(1)铁丝在纯氧中燃烧:_______,观察到的现象是_____________。
(2)电解水:__________,正极与负极产生气体的体积比是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化镁(MgO2)是一种镁精细化工产品。在医疗上可用来治疗消化不良、胃酸过多等疾病。在环境保护方面,过氧化镁可用来处理地下水污染的土壤。还可以用于牙膏,对牙齿有漂白和防过敏的作用。某化学兴趣小组对过氧化镁的性质和制备等进行了以下研究。
一.过氧化镁的性质
(1)过氧化镁(其中氧元素的化合价为 __________)是一种白色的粉末,其外观与物理性质与氧化镁相似。化学性质不够稳定,不溶于水,但逐渐的被分解放出氧气。过氧化镁有强氧化性,常温下比较稳定,但是加热时会分解生成氧气和氧化镁。请下出该反应的化学方程式____________。
(2)过氧化镁易溶于稀盐酸,发生反应:MgO2+2HCl=MgCl2+H2O2同时温度升高,说明该反应_______________热量(填“放出”或“吸收”)。
二.过氧化镁的制备
下图是利用碱式碳酸镁【Mg2( OH)2CO3】和30%的过氧化氢溶液来制取过氧化镁。
【资料】①碱式碳酸镁与碳酸镁有相似的化学性质,能与稀盐酸反应产生二氧化碳
②氧化镁与过氧化氢反应放出大量的热
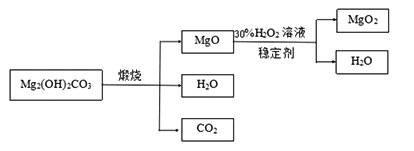
(3)检测煅烧过程碱式碳酸镁完全分解的方法是_________________(写出具体的操作和现象);上述生产过程加入稳定的剂的作用是_________________。
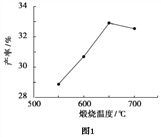
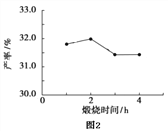
(4)用上述碱式碳酸镁在 550、600、650 及 700 ℃ 下煅烧一定的时间生成氧化镁。用上述条件制备的氧化镁分别与 30% 双氧水反应合成过氧化镁产率(见图1和图2)。碱式碳酸镁煅烧的温度适宜控制在______℃,煅烧的时间适宜控制在_____h。
(5)结果分析:在适宜的温度和时间下,碱式碳酸镁能完全分解,并且得到的氧化镁颗粒表面积最大,能与30%过氧化氢充分反应,所以产率高。推测700℃时,产率明显降低的可能的原因__________。
三.过氧化镁产品纯度检测
在生产过程中,过氧化镁中常常含有少量的氧化镁杂质(其他杂质不考虑),以下是该小组进行纯度检测的实验装置和实验步骤。
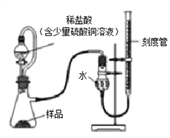
检查装置气密性,装入药品(样品质量为0.7g),调节刻度管使左右两边液面相平,刻度管度数为10.0mL。
打开分液漏斗开关,待瓶中无气泡产生时,关闭开关。
再次调节刻度管使左右两边液面相平,刻度管度数为122mL。
(6)稀盐酸中放入的少量硫酸铜溶液目的是__________________。
(7)根据上面实验数据计算样品中过氧化镁的质量分数__________(写出具体的计算过程,实验条件下O2密度为1.429g/L)。
(8)该小组同学所测得质量分数比实际结果偏大,你觉得可能的原因是(_______)
A.生成的氧气有少量溶于水 B.未等装置冷却到室温就开始读数
C.杂质与盐酸反应能产生少量的气体 D.滴入的稀盐酸占了一部分气体的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com