
| A. | SO3→H2SO4 | B. | Ca(OH)2→NaOH | C. | CuO→Cu(OH)2 | D. | CaCl2→CaCO3 |
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 所发生的反应都是置换反应 | |
| B. | 反应后都能生成二氧化碳气体 | |
| C. | 反应后都能生成红色的固体 | |
| D. | 反应前后各元素的化合价都发生了变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 盐酸的质量/g | 25 | 25 | 25 | 25 |
| 烧杯及所盛物质总质量/g | 181.2 | 204.4 | 228.6 | 253.6 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
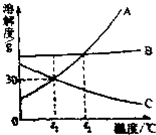 如图是A、B、C三种物质的溶解度曲线.看图回答问题:
如图是A、B、C三种物质的溶解度曲线.看图回答问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 ”表示氧原子,“
”表示氧原子,“ ”表示氢原子)
”表示氢原子)
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 次 数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的质量/g | 35.0 | 35.0 | 35.0 | 35.0 |
| 剩余固体的质量/g | 6.8 | 5.6 | 4.4 | 4.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com