为了测定盐湖析出的一定量Na2CO3中NaCl的质量,向10.9gNa2CO3(含少量NaCl)的混合物中滴加14.6%的稀盐酸至恰好完全反应时,并收集气体4.4g,回答下列问题:
(1)写出题中发生反应的化学方程式________;
(2)根据已知条件列出求解Na2CO3质量(x)的比例式________;
(3)10.9g样品中含NaCl的质量为________g;
(4)反应后向所得溶液中加入23.5g水,则其中溶质质量分数为________.
解:(1)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式为Na
2CO
3+2HCl═2NaCl+H
2O+CO
2↑
(2)设样品中碳酸钠的质量为x,生成氯化钠的质量为y,消耗HCl的质量为z
Na
2CO
3+2HCl═2NaCl+H
2O+CO
2↑
106 73 117 44
x z y 4.4g
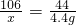
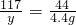
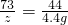
X=10.6g y=11.7g z=7.3g
反应掉的盐酸的质量=
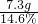
=50g
(3)样品中氯化钠质量为10.9g-10.6g=1=0.3g
(4)反应后的溶液中溶质氯化钠质量=0.3g+11.7g=12g
反应后的溶液中溶液的质量=10.9g+50g+23.5g-4.4g=80g
反应后溶液的溶质质量分数

×100%=15%
故答案为:(1)Na
2CO
3+2HCl═2NaCl+H
2O+CO
2↑ (2)
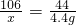
或
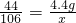
;(3)0.3g;(4)15%
分析:(1)碳酸钠与盐酸反应放出二氧化碳而氯化钠不与盐酸反应,根据方程式书写原则写出化学方程式
(2)根据反应的化学方程式,由生成二氧化碳的质量可列出计算样品中碳酸钠的质量,
(3)由(2)中比例式可求出碳酸钠质量,用总质量减去碳酸钠质量即为氯化钠质量.
(2)反应后所得溶液为氯化钠溶液,其中氯化钠由原样品中氯化钠和反应生成氯化钠两部分所组成;由生成二氧化碳质量可计算出生成的氯化钠的质量,样品质量与碳酸钠质量差则为样品中氯化钠的质量,两部分氯化钠的质量和与所得溶液的质量比可计算反应后所得溶液的溶质质量分数,其中反应后所得溶液质量可利用质量守恒定律计算求得.
点评:根据化学方程式可以表示反应中各物质的质量比,由反应中任意物质的质量可计算出反应中其它物质的质量.

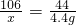
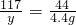
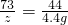
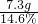 =50g
=50g ×100%=15%
×100%=15%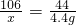 或
或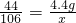 ;(3)0.3g;(4)15%
;(3)0.3g;(4)15%
