


科目:初中化学 来源: 题型:
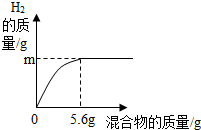 现有两种金属单质组成的混合物.向100g稀盐酸中加入该混合物,加入混合物的质量与生成氢气的质量关系如图所示.下列说法正确的是( )
现有两种金属单质组成的混合物.向100g稀盐酸中加入该混合物,加入混合物的质量与生成氢气的质量关系如图所示.下列说法正确的是( )| A、若混合物为Zn和Cu,则m大于0.2 g |
| B、若混合物为Zn和Fe,则m可能是0.2 g |
| C、若混合物为Fe和Cu,稀盐酸中溶质质量分数为7.3% |
| D、若混合物为Fe和Cu,m为0.1 g,则混合物中Fe和Cu的质量比为1:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:
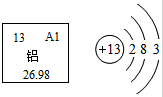 铝在生产生活中的应用非常广泛,如图为铝在元素周期表中的信息和原子结构示意图,由此不能得到的信息是( )
铝在生产生活中的应用非常广泛,如图为铝在元素周期表中的信息和原子结构示意图,由此不能得到的信息是( )| A、铝是地壳中含量最多的金属元素 |
| B、铝原子的质子数、核外电子数均为13 |
| C、在化学变化中每个铝原子可失去3个电子变成Al3+ |
| D、铝元素在化合物通常显+3价 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 加入稀硫酸的质量 | 35g | 35g | 35g | 35g |
| 剩余固体的质量 | 8.6g | 7.4g | 6.2g | 5.6g |
查看答案和解析>>
科目:初中化学 来源: 题型:
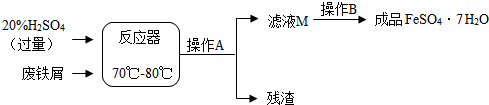
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | |
| 析出晶体 | FeSO4?7H2O | FeSO4?4H2O | FeSO4?H2O | |||||||
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com