

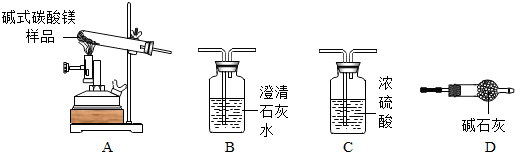
| 24 |
| 40 |
| 12 |
| 44 |
| 2 |
| 18 |
| (x+y)×24 |
| 84x+58y+18z |
| 12x |
| 84x+58y+18z |
| 2z |
| 84x+58y+18z |


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:初中化学 来源: 题型:
| A、钙Ca>钠Na>镁Mg |
| B、铝Al>铁Fe>锡Xi |
| C、铅Pb>铜Cu>贡Hg |
| D、金Au>银Ag>铂Pt |
查看答案和解析>>
科目:初中化学 来源: 题型:
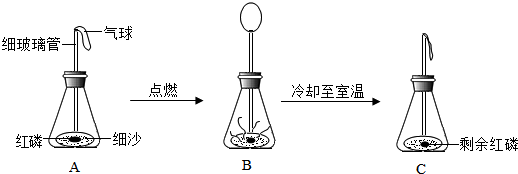
查看答案和解析>>
科目:初中化学 来源: 题型:
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | 3Li 锂 6.941 |
4 Be 铍 9.012 |
5B 硼 10.81 |
6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 16.00 |
9 F 氟 19.00 |
10 Ne 氖 10.18 |
| 3 | 11 Na 钠 22.99 |
12 Mg 镁 14.31 |
13 Al 铝 16.98 |
14 Si 硅 28.09 |
15 P 磷 30.97 |
16 S 硫 32.06 |
17 Cl 氯 35.45 |
18 Ar 氩 39.95 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| △ |
| 高温 |
| 高温 |
| A、①属于化合反应 |
| B、Na2SiO3中Si元素的化合价为+4价 |
| C、反应③中氧化剂是C |
| D、Si和SiO2可以相互转化 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 名称 | 洗涤灵 | 洁厕灵 | 炉具清洁剂 | 污渍爆炸盐[来源 | 漂白粉 |
| 产品样式 |  |
 |
 |
 |
 |
| 有效成分 或功能 |
清洗油污 | 盐酸 | 氢氧化钠 | 过碳酸钠 | 消毒 |

| 实验步骤 | 实验现象 | 实验结论 |
| 把少量漂白粉样品加入水中,通入足量的CO2气体, |
漂白粉的漂白作用已完全失效. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com