
| 反应前 | 反应后 | |
| Ⅰ 组 | 玻璃管和红色粉末的总质量为37g | 玻璃管和固体物质的总质量为34.6g |
| Ⅱ 组 | 洗气瓶B和所盛溶液的总质量为180.0g | 洗气瓶B和瓶中物质的总质量为181.1g |
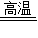 2Fe+3CO2 固体质量减少
2Fe+3CO2 固体质量减少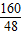 =
=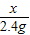
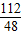 =
=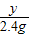 ,解得y=5.6g,反应前后元素的质量不变,所以反应后固体中铁粉的质量是5.6g,原固体粉末中氧化铁的质量是2.4g+5.6g=8g;
,解得y=5.6g,反应前后元素的质量不变,所以反应后固体中铁粉的质量是5.6g,原固体粉末中氧化铁的质量是2.4g+5.6g=8g;

科目:初中化学 来源: 题型:阅读理解
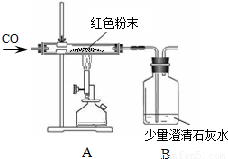
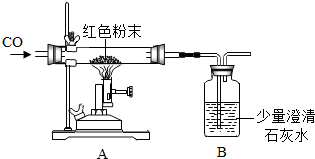 (2012?青岛模拟)现有一包干燥的红色粉末,它是由Cu、Fe2O3二种固体中的一种或两种组成,某化学兴趣小组对这包红色粉末的组成进行探究.请你参与并回答有关问题.
(2012?青岛模拟)现有一包干燥的红色粉末,它是由Cu、Fe2O3二种固体中的一种或两种组成,某化学兴趣小组对这包红色粉末的组成进行探究.请你参与并回答有关问题.| 反应前 | 反应后 | |
| Ⅰ 组 |
玻璃管和红色粉末的总质量为37g | 玻璃管和固体物质的总质量为34.6g |
| Ⅱ 组 |
洗气瓶B和所盛溶液的总质量为180.0g | 洗气瓶B和瓶中物质的总质量为181.1g |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
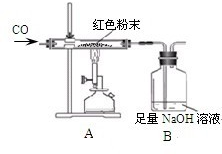 周三的化学兴趣活动中,小吴同学拿出一包干燥的红色粉末,同学们对其组成进行探究.根据该红色粉末的来源,老师判断其可能由Cu、Fe2O3两种固体中的一种或两种组成.
周三的化学兴趣活动中,小吴同学拿出一包干燥的红色粉末,同学们对其组成进行探究.根据该红色粉末的来源,老师判断其可能由Cu、Fe2O3两种固体中的一种或两种组成.| 反应前 | 反应后 | |
| Ⅰ 组 |
玻璃管和红色粉末的总质量为48.3g | 玻璃管和固体物质的总质量为47.1g |
| Ⅱ 组 |
洗气瓶和瓶中所盛物质的总质量为258.6g | 洗气瓶和瓶中所盛物质的总质量为261.9g |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
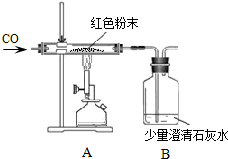 现有一包干燥的红色粉末,它是由Cu、Fe2O3二种固体中的一种或两种组成,某化学兴趣小组对这包红色粉末的组成进行探究.请你参与并回答有关问题.
现有一包干燥的红色粉末,它是由Cu、Fe2O3二种固体中的一种或两种组成,某化学兴趣小组对这包红色粉末的组成进行探究.请你参与并回答有关问题.| 反应前 | 反应后 | |
| Ⅰ 组 | 玻璃管和红色粉末的总质量为37g | 玻璃管和固体物质的总质量为34.6g |
| Ⅱ 组 | 洗气瓶B和所盛溶液的总质量为180.0g | 洗气瓶B和瓶中物质的总质量为181.1g |
查看答案和解析>>
科目:初中化学 来源:2012年山东省青岛市中考调研化学试卷(解析版) 题型:解答题
| 反应前 | 反应后 | |
| Ⅰ 组 | 玻璃管和红色粉末的总质量为37g | 玻璃管和固体物质的总质量为34.6g |
| Ⅱ 组 | 洗气瓶B和所盛溶液的总质量为180.0g | 洗气瓶B和瓶中物质的总质量为181.1g |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com