
质量相等、溶质质量分数也相等的苛性钠溶液和稀硫酸充分混合,混合后溶液的
pH为[
]|
A .等于0 |
B .大于7 |
|
C .小于7 |
D .等于7 |
|
解析:解此题首先应知道溶液的 pH与溶液酸碱性的关系,当pH=7时,溶液呈中性;当pH=7时,溶液呈碱性;当pH<7时,溶液呈酸性.题中信息NaOH与 分别是等质量、等质量分数混合,混合后溶液的pH是大于7,等于7,还是小于7,关键取决于NaOH与 分别是等质量、等质量分数混合,混合后溶液的pH是大于7,等于7,还是小于7,关键取决于NaOH与 是否完全反应,还是哪种物质有剩余,如果完全反应pH=7,如果NaOH剩余pH>7,如果 是否完全反应,还是哪种物质有剩余,如果完全反应pH=7,如果NaOH剩余pH>7,如果 有剩余,pH<7.因此要看参加反应的两种物质的质量比: 有剩余,pH<7.因此要看参加反应的两种物质的质量比:
每反应掉 80份质量的NaOH,需要98份质量的 ,而NaOH与 ,而NaOH与 溶液质量相等,溶质质量分数也相等,可见NaOH有剩余,溶液显碱性,pH大于7,所以B正确. 溶液质量相等,溶质质量分数也相等,可见NaOH有剩余,溶液显碱性,pH大于7,所以B正确. |
|
点拨:此题是一道酸碱中和反应后判断其溶液的 pH大小的题,关键判断NaOH与 是否完全反应,是 是否完全反应,是 剩余,还是NaOH剩余,这由两种物质参加反应的质量比决定. 剩余,还是NaOH剩余,这由两种物质参加反应的质量比决定. |


科目:初中化学 来源: 题型:阅读理解
| 反应时间 | t0 | t1 | t2 | t3 |
| 烧杯和药品的质量/g | 166.5 | 166.3 | 166.1 | 166.1 |
查看答案和解析>>
科目:初中化学 来源:2012年初中毕业升学考试(云南昭通卷)化学(解析版) 题型:选择题
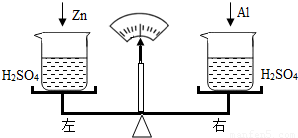
(2分)(2012•昭通)将盛有等质量、等溶质质量分数的稀硫酸的两只烧杯,放在托盘天平左右两盘上,调节至平衡,再向两只烧杯中分别放入质量相等的铁和锌,待反应停止后(不考虑反应中水分挥发,不考虑空气成分参加反应),请判断,下列说法合理的是( )
A.若天平仍保持平衡,烧杯中的铁一定没有剩余
B.若天平失去平衡,指针一定偏向放锌的一边
C.反应后两只烧杯中溶液的质量都比反应前的溶液质量减轻了
D.放铁的一边产生的氢气一定比放锌的一边产生的氢气多
查看答案和解析>>
科目:初中化学 来源: 题型:
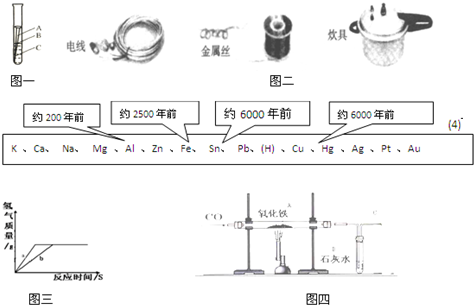
26.(6分)用下列仪器和试剂验证影响金属与盐酸反应速率的因素:烧杯、试管夹、酒精灯、药匙、量筒、天平。锌片、铁片、镁片。5%盐酸、20%盐酸。
(一)不同金属与酸反应的快慢不同
取质量相等的上述两种金属,分别放入溶质质量分数相同的足量稀盐酸中,
生成氢气的质量(m)与反应时间(t)的关系曲线如图1所示。

![]()
(1)金属活动性顺序表(填元素符号)
K、Ca、Na、 、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au
(2)线B对应的金属为 。
(3)线A对应的金属与稀盐酸反应的化学方程式 。
(二)金属与不同质量分数的盐酸反应的快慢不同
取质量相等的锌片,分别放入5%、20%的足量稀盐酸中。
生成氢气的质量为m,反应时间为t。5%的盐酸与锌片反应m与t的关系曲线如图2所示。请在该图上补画出20%的盐酸与锌片反应m与 t的关系曲线。
实验表明,盐酸质量分数越大,与金属反应的速率越快。

![]()
(三)温度对金属与盐酸反应速率也有影响
取两个烧杯,分别加入等质量的 (“同种”、 “不同种”)金属,再分别加入足量的质量分数 (“相同”、 “不相同”)的稀盐酸……实验表明,温度越高,盐酸与金属反应的速率越快。
查看答案和解析>>
科目:初中化学 来源:2010年山东省青岛市中考化学模拟试卷(四)(解析版) 题型:选择题
查看答案和解析>>
科目:初中化学 来源: 题型:
小刚同学绘制了如右图所示A、B两种固体物质的溶解度曲线。
 (1)温度为t1℃时,A物质与B物质的溶解度 (填“相等”、“不相等”或“不能比较”)。
(1)温度为t1℃时,A物质与B物质的溶解度 (填“相等”、“不相等”或“不能比较”)。
(2)将A物质t2℃时的饱和溶液降低温度至t1℃时,其溶质质量分
数 (填:“变大”、“变小”、“不变”)。
(3)我国有许多盐碱湖,湖中溶有大量的NaCl和Na2CO3,那里的人们冬天捞碱,夏天晒盐。据此我认为右图中(填字母) 曲线与纯碱的溶解度曲线相似。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com