


科目:初中化学 来源: 题型:阅读理解
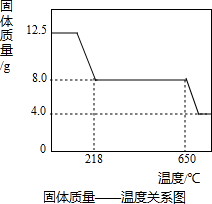 某企业是一家以生产电缆类产品为主的地方明星企业.在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆).某化学兴趣小组的同学得知这一情况后,提出可以用含铜废料制备胆矾(CuSO4?5H2O).
某企业是一家以生产电缆类产品为主的地方明星企业.在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆).某化学兴趣小组的同学得知这一情况后,提出可以用含铜废料制备胆矾(CuSO4?5H2O).

查看答案和解析>>
科目:初中化学 来源: 题型:
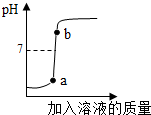 (2013?雨花台区一模)实验室欲用已配好的质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),配制100g质量分数为5%的氢氧化钠溶液,并用此溶液测定某硫酸溶液的溶质质量分数.
(2013?雨花台区一模)实验室欲用已配好的质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),配制100g质量分数为5%的氢氧化钠溶液,并用此溶液测定某硫酸溶液的溶质质量分数.| 80 |
| 98 |
| 80g×5% |
| X |
| 4.9g |
| 50g |
| 80 |
| 98 |
| 80g×5% |
| X |
| 4.9g |
| 50g |
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:2006年4月洋思中学初三化学实验与探究专项练习 题型:058
| |||||||||||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com