
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:实验探究题
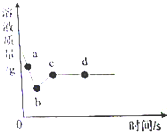 小郑和小飞两位同学设计实验,证明Zn、Cu、Ag三种金属的活动性强弱,方案如下:(所用仪器仅限试管、胶头滴管)
小郑和小飞两位同学设计实验,证明Zn、Cu、Ag三种金属的活动性强弱,方案如下:(所用仪器仅限试管、胶头滴管)查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
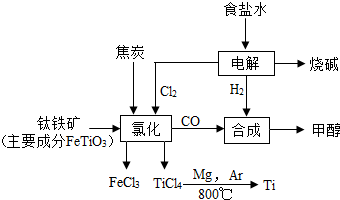 钛(Ti)被称为继铁、铝之后的第三金属.如图所示,将钛厂、氯碱厂和甲醇(CH4O)厂组成产业链可以大大提高资源利用率,减少环境污染.
钛(Ti)被称为继铁、铝之后的第三金属.如图所示,将钛厂、氯碱厂和甲醇(CH4O)厂组成产业链可以大大提高资源利用率,减少环境污染.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
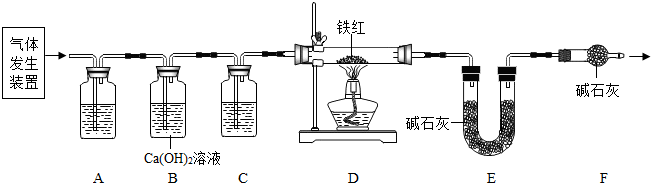
| 铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 铁的质量分数 | 77.8% | 70.0% | 72.4% |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com