
| 实验 | 实验一 | 实验二 | 实验三 |
| 实验方案 |  | 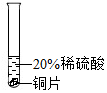 | 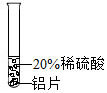 |
| 实验现象 | 铬片表面产生气泡缓慢,溶液变为蓝色 | 无明显现象 | 铝片表面产生气泡较快 |
| 结论 | 铬能与稀硫酸反应,反应速率较慢 | 铜不与稀硫酸反应 | 铝能与稀硫酸发生反应,反应速率较快 |
| 三种金属在金属活动性顺序中的相对位置关系是Al>Cr>Cu. | |||
分析 本题中,题目首先给出了三个实验探究方案,可以根据金属与酸或盐的反应规律,就能够解决.
回答问题:(1)砂纸打磨是为了除去金属表面的氧化物或污染物;
(2)根据铬与稀硫酸反应生成硫酸铬和氢气书写;
(3)铬和铝都能和硫酸铜反应,不能检验铬和铝的活动性;
(4)本题开放性比较强,答案不唯一,可以采取“三取中”的检验思路选用Al、CrSO4溶液、Cu,也可以用Al2(SO4)3溶液、Cr、CuSO4溶液,完成活动性验证.
归纳:通过金属和酸的反应现象判断金属的活动性,还可以根据金属和盐溶液的反应判断金属的活动性.
解答 解:根据题设中的实验现象:铬片表面产生气泡缓慢,铜片无明显现象,铝片表面产生气泡较快;可判断:铝能与稀硫酸发生反应,反应速率较快;铬能与稀硫酸发生反应,反应速率缓慢;铜不能与稀硫酸发生反应,则三种金属在金属活动性顺序中的相对位置关系是:Al Cr Cu(或“②”);
回答问题:
(1)砂纸打磨是为了除去金属表面氧化物;
(2)由资料可知,铬能与稀硫酸反应,生成蓝色的硫酸亚铬( CrSO4)溶液,反应的化学方程式为:Cr+H2SO4=CrSO4+H2↑;
(3)铬和铝都能和硫酸铜反应,不能检验铬和铝的活动性;
(4)利用“三取中”的实验方法,可以用Al、CrSO4溶液、Cu;也可以用Al2(SO4)3溶液、Cr、CuSO4溶液.
归纳:通过金属和酸的反应现象判断金属的活动性,还可以根据金属和盐溶液的反应判断金属的活动性.
故答案为:结论:Al>Cr>Cu;
回答问题:(1)除去金属表面氧化物;
(2)Cr+H2SO4=CrSO4+H2↑;
(3)不可行;
(4)A1、CrSO4溶液、Cu;
归纳:①通过金属与酸反应判断金属活动性强弱.
点评 验证三种金属活动性强弱关系时,通常采取“三取中”即:取中间金属单质与两端的金属的盐溶液反应或取中间金属的盐溶液与两端金属的单质反应.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图,将一支盛有CO2的试管倒立砸一个装满水的烧杯中看到试管内液面上升一段水柱;原因是二氧化碳能与水反应生成碳酸,使试管内气体压强减小,在外界大气压的作用下液体被压入试管内,所以试管内液面上升
如图,将一支盛有CO2的试管倒立砸一个装满水的烧杯中看到试管内液面上升一段水柱;原因是二氧化碳能与水反应生成碳酸,使试管内气体压强减小,在外界大气压的作用下液体被压入试管内,所以试管内液面上升查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com