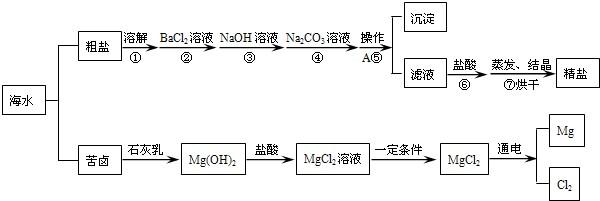
海水经过晒盐后得到粗盐和苦卤,重结晶后的食盐中还含有硫酸钠、氯化镁、氯化钙等可溶性杂质,他们在溶液中主要以SO42-、Ca2+、Mg2+的形式存在,为将这些杂质离子除净,应加入过量的氯化钡、氢氧化钠、碳酸钠等物质将其转化为沉淀,过滤除去;再加入适量的盐酸,得到精盐水,最后经蒸发即得精盐.以下是某化工厂对海水进行综合利用的示意图:
(1)在苦卤制镁的过程中加入了石灰乳(主要成分是氢氧化钙),石灰乳是用生石灰制得的,请写出制取石灰乳的化学方程式 .
(2)在制备精盐的过程中,氯化钡和碳酸钠溶液的添加顺序是否可以颠倒 ,理由是 ;
(3)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是 .
【答案】分析:(1)石灰乳的主要成份是氢氧化钙,生石灰的主要成份是氧化钙,根据氧化钙与氢氧化钙的转化解答.
(2)根据氯化钡和碳酸钠在除杂过程中的作用解答.
(3)根据⑥步之前的溶液成份以及盐酸参与的反应解答.
解答:解:(1)石灰乳的主要成份是氢氧化钙,生石灰是氧化钙,生石灰与水反应生成氢氧化钙,故答案为:CaO+H2O═Ca(OH)2.
(2)氯化钡只能将硫酸根离子转化为沉淀,而碳酸钠既可以将钙离子沉淀,又可将钡离子沉淀,如果颠倒,多余的钡离子也就成了杂质,故答案为:不可以,碳酸钠既可以将钙离子沉淀,又可以将多余的钡离子沉淀.
(3)经过前面五步的反应,溶液中还有过量的碳酸钠和氢氧化钠,而它们对于氯化钠来说也是杂质,需要将其转化,又不能引入新的杂质,故答案为:除去多余的氢氧化钠和碳酸钠.
点评:本题主要考查了在粗盐提纯的过程中,加入的各种物质的作用以及顺序,逻辑性较强.