
(3分)小明将19.4克部分变质的氢氧化钠放入185克稀盐酸中,恰好完全反应,得到食盐溶液200克。小明将所得食盐溶液蒸发掉46克水,得到16%的食盐溶液用于选种。请计算:
(1)利用上述实验小明测得样品中氢氧化钠的质量分数是多少?
(2)200克食盐溶液中溶质的质量分数是多少?
(1)45.4%;(2)12.32%
解析试题分析:(1)根据样品中氢氧化钠的质量分数=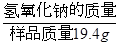 ×100%可知,只要求出氢氧化钠质量即可;根据题意,变质的氢氧化钠19.4g与185g稀盐酸恰好完全反应得到200g食盐溶液,根据质量守恒定律可知,放出二氧化碳的质量为19.4g+185g-200g=4.4g,由二氧化碳质量,利用二氧化碳与碳酸钠的质量比,可计算样品中碳酸钠的质量,则样品质量-碳酸钠质量=氢氧化钠质量。
×100%可知,只要求出氢氧化钠质量即可;根据题意,变质的氢氧化钠19.4g与185g稀盐酸恰好完全反应得到200g食盐溶液,根据质量守恒定律可知,放出二氧化碳的质量为19.4g+185g-200g=4.4g,由二氧化碳质量,利用二氧化碳与碳酸钠的质量比,可计算样品中碳酸钠的质量,则样品质量-碳酸钠质量=氢氧化钠质量。
解:设样品中碳酸钠的质量为x
根据质量守恒定律,反应生成CO2的质量为19.4g+185g-200g=4.4g
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
106 44
x 4.4g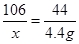
解得,x=10.6g
则样品中氢氧化钠的质量分数=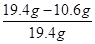 ×100%=45.4%
×100%=45.4%
(2)根据蒸发水溶质质量不变,由蒸发后溶液计算出氯化钠的质量,然后利用溶质与溶液质量比计算200克食盐溶液中溶质的质量分数即可。
蒸发后溶液中溶质的质量为(200g-46g)×16%=24.64g
则蒸发前200克食盐溶液中溶质质量分数=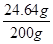 ×100%=12.32%
×100%=12.32%
答:(1)小明测得样品中氢氧化钠的质量分数是45.4%;(2)200克食盐溶液中溶质的质量分数是12.32%。
考点:有关溶质质量分数的简单计算,根据化学反应方程式的计算
点评:此题是关于化学方程式及溶质质量分数的计算题,要求学生有较强的分析能力;解题的关键是,要会利用质量守恒定律,由变质氢氧化钠与盐酸反应前后质量的变化计算出反应放出二氧化碳的质量,这是本题所隐藏的关键条件;然后再根据相关的化学反应方程式,并依据已知量对未知的应求量进行求解计算即可,注意解题要规范。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:河东区二模 题型:问答题
查看答案和解析>>
科目:初中化学 来源:2012年天津市河东区中考化学二模试卷(解析版) 题型:解答题
查看答案和解析>>
科目:初中化学 来源:2011年北京市顺义区中考化学二模试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com